
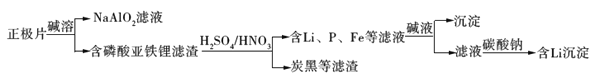
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li、C
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
【答案】BD
【解析】
正极片经碱溶可得到NaAlO2,可说明含有Al元素,含有磷酸亚铁锂的滤渣加入硫酸、硝酸,可除去炭黑等,得到含有P、Fe、Li的滤液,加入碱液,生成的沉淀为Fe(OH)3,滤液加入碳酸钠,可生成碳酸锂沉淀,据此分析解答。
A.废旧电池会污染土壤和水体,合理处理废旧电池,可减少污染,且回收含有Al、Fe等金属,可节约资源,故A正确;
B.由以上分析可知从“正极片”中可回收的金属元素有Al、Fe、Li等,C属于非金属,故B错误;
C.硝酸具有强氧化性,可氧化亚铁离子生成铁离子,则“沉淀”反应的金属离子为Fe3+,故C正确;
D.硫酸锂易溶于水,加入硫酸钠,不能生成含Li沉淀,故D错误;
答案选BD。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物G是一种药物中间体,合成 G的部分流程如下:

请回答下列问题:
(1)G物质中的含氧官能团的名称是___________、____________。
(2)上述⑤变化过程的反应类型是_____________。
(3)反应A→B的化学方程式为________________________________________。
(4)写出满足下列条件的C的同分异构体的结构简式:_______________________。
Ⅰ. 苯环上只有两种取代基。
Ⅱ. 分子中只有4种不同化学环境的氢。
Ⅲ. 能与NaHCO3反应生成CO2。
(5)根据已有知识并结合相关信息,写出以![]() 和乙酸酐为原料制备
和乙酸酐为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________
CH3CH2OH__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:

已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3,Fe2+在pH约为9时可完全转化为Fe(OH)2
(1)工业上常将“过滤Ⅰ”的滤液和滤渣洗涤液合并,其目的是____。
(2)“氧化”过程发生的离子方程式为___。
(3)“沉铁”过程中加入碳酸钠调节溶液的pH至2,碳酸钠过多会导致生成的沉淀由黄钠铁钒转变为_____(填化学式)。
(4)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在不同浓度的氢氧化钠溶液中反应,含镍产物的XRD图谱如图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯纳米镍粉最适宜的NaOH的浓度为____。写出该条件下制备纳米镍粉同时生成N2的离子方程式:_____。

(5)不同NaOH浓度下,产物Ni的含量不同,可能的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。下列说法错误的是

A. 浸泡时加入乙醇有利于中草药有效成分的浸出
B. 高温条件下更有利于超临界CO2萃取
C. 升温、减压的目的是实现CO2与产品分离
D. CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:

已知:钒有多种价态,其中+5价最稳定。钒在溶液中主要以![]() 和
和![]() 的形式存在,且存在平衡VO2++H2O
的形式存在,且存在平衡VO2++H2O![]() VO3-+2H+。下列说法正确的是
VO3-+2H+。下列说法正确的是
A. 工业生产中,碱浸步骤可选用较为廉价的氨水
B. 可以推测VO2Cl溶解度大于NH4VO3
C. 焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全
D. 将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中一定不含铁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的前四周期的主族元素A~H,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,用相应的化学式回答有关问题:
(1)元素A与C的原子个数比为1:1的化合物的电子式为_______。
(2)元素B、C、D的第一电离能由大到小的顺序为_______
(3)元素C、F形成的阴离子FC32-空间构型为_______
(4)元素G、H的气态氢化物的稳定性由强到弱顺序为________
(5)元素C、F的气态氢化物沸点由高到低的顺序为______,原因是______
(6)元素E的氢化物(EH4)属于_______分子(填“极性”或“非极性”)
(7)铬的基态原子价电子排布式为______。
(8)尿素[H2NCONH2]分子中,C原子的杂化方式为____;1mol尿素分子中,σ键的数目为______。
(9)带有六个结晶水三氯化铁,是橘黄色的晶体,其化学式为[Fe(H2O)6]Cl3,该化合物中,与Fe3+形成配位键的原子是______,写出H2O的一种阴离子的等电子体______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气的主要污染物,是当前环保工作的重要研究内容之一。
(1)氨气还原氮的氧化物
①N2(g)+O2(g)=2NO(g) △H1 ②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=________。(用含△H1、△H2的式子表示)
依据反应②,可将氨气直接用于燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:______________________________。

(2)一定温度下,向2L恒容密闭容器中充入4.0mol NO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H<0,测得相关数据如下:
N2(g)+4CO2(g) △H<0,测得相关数据如下:
①0~5min,用NO2的浓度变化表示的反应速率为____。
②以下表述能说明该反应己达到平衡状态的是____。
A.气体颜色不再变化 B.气体密度不再变化 C.气体平均相对分子质量不再变化
③20 min时,保持温度不变,继续向该容器中加入l.0mol NO2和l.0molCO,在t1时反应再次达到平衡,则NO2的转化率比原平衡____(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K= _____。
(3)湿法脱硝:采用NaClO2 溶液作为吸收剂可对烟气进行脱硝。323 K 下,向足量碱性NaClO2 溶液中通入含NO 的烟气,充分反应后,溶液中离子浓度的分析结果如下表:
离子 | NO3- | NO2- | Cl- |
c/(mol L-1) | 2.0×10-4 | 1.0×10-4 | 1.75×10-4 |
①NaClO2 溶液显碱性,用离子方程式解释原因_______________________。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石油是混合物,汽油是纯净物
B.沸点:汽油>煤油>柴油>润滑油
C.直馏汽油和裂化汽油成分完全相同
D.石油的分馏是物理变化,而裂化和裂解属于化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com