
【题目】电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶性的物质 |
质量分数/% | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
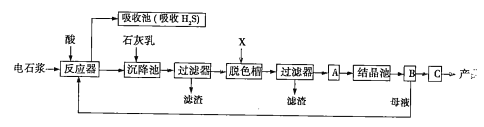
已知氯化钙晶体的化学式是CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用______________。
(2)脱色槽中应加入的物质X是__________;设备A的作用是__________;设备B的名称为__________;设备C的作用是_______________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_______(填序号)。反应的化学方程式为____________________________。
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______________________。
【答案】盐酸 活性炭 蒸发浓缩 过滤器 脱水干燥 C Ca(OH)2+H2S=CaS+2H2O 对母液回收利用,降低废弃物排放量,提高经济效益
【解析】
电石浆加入酸,其中含有的氧化钙,氧化铝、氧化铁、氧化镁、硫化钙溶于酸,经沉降后过滤得到滤渣为二氧化硅和不溶性杂质,加入活性炭脱色过滤后,在A中蒸发浓缩得到晶体,B中过滤得到晶体,通过C脱水干燥得到产品。
(1)因目的是生产CaCl2,在处理过程中不引入新的杂质离子,所以反应器中加入的酸应选用盐酸;
(2)活性炭具有吸附性,故脱色槽中应加入的物质X是活性炭;从A装置后面看是结晶池,则在A中可进行的操作是溶液脱水,A为蒸发浓缩;从B中有母液出来,则B为过滤器;B中得到晶体,所以需要脱水干燥,才能得到CaCl2产品,故设备C的作用是脱水干燥;
(3)H2S为酸性气体,应用碱液吸收,应该选石灰乳,该反应的化学方程式为Ca(OH)2+H2S=CaS+2H2O,故合理选项是C;
(4)设备B中产生的母液中含有氯化物,经回收利用,不仅可以降低废弃物排放量,而且可以提高经济效益,故将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益。


科目:高中化学 来源: 题型:
【题目】铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
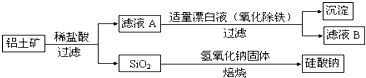
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□ ═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1 L的三个密闭容器中,分别放入铁粉并充入1 mol CO,控制在不同温度下发生反应:Fe(s)+5CO(g)![]() Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的( )
Fe(CO)5(g),当反应进行到5 min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的( )
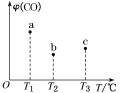
A.反应进行到5 min时,b容器中v(正)=v(逆)
B.正反应为吸热反应
C.b中v(正)大于a中v(逆)
D.达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。

回答下列问题:
(1)CeFCO3中Ce的化合价为___________。
(2)氧化培烧时不能使用陶瓷容器,原因是_________________。氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为____________________。操作Ⅰ的名称为_________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为Ce3+(水层)+3HT(有机层) ![]() CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
CeT3(有机层)+3H+(水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:____________________。
(5)298K时,向c(Ce3+)=0.02mol·L-1的溶液中加入氢氧化钠来调节溶液的pH,若反应后溶液pH=10,此时Ce3+是否沉淀完全?__________________{列式计算,已知:Ksp[Ce(OH)3]5×l0-20,c(Ce3+)-5mol·L-1 视为沉淀完全}。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
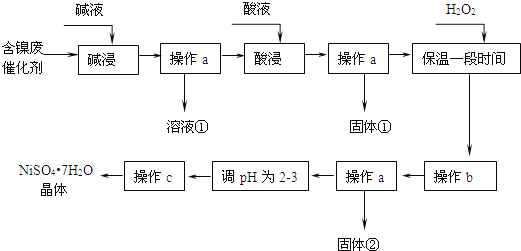
【题目】镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品![]() 主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质
主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质![]() 某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
沉淀物 | 开始沉淀 | 完全沉淀 |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
![]() 溶液
溶液![]() 中含金属元素的离子是 ______ .
中含金属元素的离子是 ______ .
![]() 用离子方程式表示加入双氧水的目的 ______
用离子方程式表示加入双氧水的目的 ______ ![]() 双氧水可以用下列物质替代的是 ______ .
双氧水可以用下列物质替代的是 ______ .
A.氧气![]() 漂液
漂液![]() 氯气
氯气![]() 硝酸
硝酸
![]() 操作b调节溶液范围为
操作b调节溶液范围为![]() ,其目的是 ______ .
,其目的是 ______ .
![]() 操作a和c需要共同的玻璃仪器是 ______
操作a和c需要共同的玻璃仪器是 ______ ![]() 上述流程中,防止浓缩结晶过程中
上述流程中,防止浓缩结晶过程中![]() 水解的措施是 ______ .
水解的措施是 ______ .
![]() 如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 ______
如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 ______ ![]() 设计实验证明产品中是否含“杂质”
设计实验证明产品中是否含“杂质”![]() 不考虑硫酸镍影响
不考虑硫酸镍影响![]() : ______ .
: ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的NaOH溶液与CH3COONa溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是( )
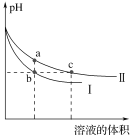
A. c点的溶液中c(OH)+c(CH3COOH)=c(H+)
B. a、b两点溶液的导电性:a>b
C. b、c两点溶液中水的电离程度:b=c
D. 用相同浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸的体积:Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是
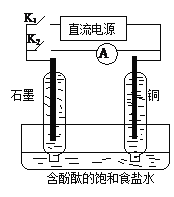
A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2)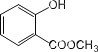 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com