
【题目】规律提炼题组
完成下列与溶液pH有关的计算,并提炼解题规律。
(1)室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为_______
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液中的氢离子浓度为 _____
(3)某温度时,水的KW=10-13,将此温度下pH=12的NaOH溶液aL与pH=2的H2SO4溶液bL混合:,
①若所得混合溶液为中性,则a:b= ____
②若所得混合溶液pH=3,则a:b=_____
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下,若将100体积pH1=a的H2SO4溶液与1体积pH2=b的NaOH溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________(用含a、b的表达式表示)
(5)(学法题)总结归纳求混合溶液pH时,应注意的问题:__________________
【答案】 106:1 2×10-11 1:10 9:101 a+b=14 求混合溶液pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH
【解析】试题分析:(1)pH=4的NH4Cl溶液和HCl溶液中![]() ,
,![]() ,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液呈碱性,先计算氢氧根离子浓度,再根据
,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,溶液呈碱性,先计算氢氧根离子浓度,再根据![]() 计算氢离子浓度; (3)某温度时,水的KW=10-13,此温度下pH=12的NaOH溶液中
计算氢离子浓度; (3)某温度时,水的KW=10-13,此温度下pH=12的NaOH溶液中![]() mol/L, pH=2的H2SO4溶液中
mol/L, pH=2的H2SO4溶液中![]() ;①若所得混合溶液为中性,则n(OH-)=n(H+);②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为
;①若所得混合溶液为中性,则n(OH-)=n(H+);②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为![]() ;(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下
;(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下![]() , pH1=a的H2SO4溶液溶液中
, pH1=a的H2SO4溶液溶液中![]() 、pH2=b的NaOH溶液中
、pH2=b的NaOH溶液中![]() ,混合后溶液呈中性,则n(OH-)=n(H+);
,混合后溶液呈中性,则n(OH-)=n(H+);
解析:(1)pH=4的NH4Cl溶液和HCl溶液中![]() ,
,![]() ,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;所以NH4Cl溶液中由水电离出的c(H+)=
,NH4Cl水解促进水电离,HCl电离出的氢离子抑制水电离;所以NH4Cl溶液中由水电离出的c(H+)=![]() ,HCl溶液中由水电离出的c(H+)=
,HCl溶液中由水电离出的c(H+)=![]() ,室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为
,室温下pH=4的NH4Cl溶液和HCl溶液中由水电离出的c(H+)之比为![]() 106:1 ;
106:1 ;
(2)在25℃时,pH等于9和pH等于11的两种氢氧化钠溶液等体积混合后,![]() ,
,![]() ;
;
(3)①若所得混合溶液为中性,则![]() ,即
,即![]() ,所以a:b=1:10;②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为
,所以a:b=1:10;②若所得混合溶液pH=3,则反应后剩余氢离子的浓度为![]() ,则a:b=9:101;
,则a:b=9:101;
(4)已知某温度时0.1 molL-1NaOH pH等于11,在此温度下![]() , pH1=a的H2SO4溶液溶液中
, pH1=a的H2SO4溶液溶液中![]() 、pH2=b的NaOH溶液中
、pH2=b的NaOH溶液中![]() ,混合后溶液呈中性,则
,混合后溶液呈中性,则![]() ;a+b=14;
;a+b=14;
(5)求混合溶液的pH时,若混合后溶液呈酸性直接计算氢离子浓度,再求pH,若溶液呈碱性,先计算氢氧根离子浓度,再根据水的离子积计算氢离子浓度,再计算pH。


科目:高中化学 来源: 题型:
【题目】下列物质与指定物质的主要成分对应正确的是
A. 赤铁矿—Fe2O3 B. 漂白粉—NaClO
C. 纯碱—NaOH D. 大理石—Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 2.1g丙烯中所含的共用电子对总数为0.3NA
B. 4.6gNO2和N2O4的混合气体中含有的氮原子数为0.1NA
C. 过氧化氢分解制得标准状况下2.24LO2,转移电子数目为0.4NA
D. 在高温高压、催化剂的条件下,56gN2和12gH2充分反应,生成NH3的分子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)已知有以下物质相互转化。
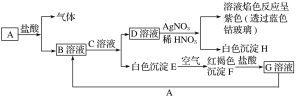
试回答下列问题:
(1)B的化学式为__________,D的化学式为________。
(2)由E转变成F的化学方程式为___________________________。
(3)用KSCN鉴别G溶液的离子方程式为_______________________;
向G溶液加入A的有关反应离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如下图所示,下列叙述不正确的是
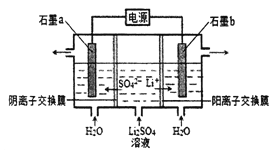
A. b极附近溶液的pH增大
B. a极反应为2H2O-4e-= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和H2
D. 当电路中通过1mol 电子时,有2mol LiOH生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求计算
(1)0.5mol H2SO4 的质量是 g,其中含有 mol S, 个O.
(2)同温同压下,等体积的CO和CO2的物质的量之比 ,质量比 ,所含氧元素的质量比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的离子方程式不正确的是
A. 铝片放入NaOH溶液中有气体产生:2Al + 2OH-+ 2H2O===2AlO2-+3H2↑
B. 向K2Cr2O7溶液中滴加少量浓H2SO4,溶液橙色加深: Cr2O72-(橙色) + H2O![]() 2CrO42-(黄色) + 2H+
2CrO42-(黄色) + 2H+
C. 向Na2SiO3溶液中通入过量CO2制备硅酸凝胶:SiO32-+ CO2 + H2O===H2SiO3(胶体)+ CO32-
D. 用Na2CO3溶液浸泡锅炉水垢(含CaSO4):CaSO4 + CO32-![]() CaCO3 + SO42-
CaCO3 + SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中发生反应:xA(g) +B(g)![]() 2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是
2C(g) △H<0,A、 C的物质的量随时间变化的关系如图。下列有关说法正确的是

A. x=1
B. 反应进行到1min时,反应体系达到化学平衡状态
C. 2min后,A的正反应速率一定等于C的逆反应速率
D. 2min后,容器中A与B的物质的量之比一定为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com