
【题目】Ⅰ.恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____ mol/(L·s)。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A.压强不再变化 B.v(A)正=2v(B)逆
C 气体密度不再变化 D.A的百分含量保持不变
E.A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”),负极反应式为______。
(2)当有 1mol电子流经外电路时,负极质量减少______g。
(3)溶液中的 OH-向________极迁移(填“Ag2O”或“Al”)。
【答案】0.01 3 BCD 正 Al+4OH--3e-=AlO2-+2H2O 9 Al
【解析】
I.(1)根据化学反应速率的概念计算v(C);
(2)根据速率比等于化学计量数的比,先计算出v(B),在计算x的值;
(3)根据平衡状态时正、逆反应速率相等,任何一组分的质量、物质的量及含量不变分析、判断;
II.在Al-Ag2O动力电池中,由于活动性Al>Ag2O,所以Al是负极,Ag2O是正极;阳离子向正极移动,阴离子向负极移动,在同一闭合回路中电子转移数目相等。
I.(1)v(C)=![]() =0.01mol/(L·s);
=0.01mol/(L·s);
(2) v(B)=![]() =
=![]() mol/(L·s),v(B):v(C)=1:x=
mol/(L·s),v(B):v(C)=1:x=![]() :0.01,解得x=3;
:0.01,解得x=3;
(3)A.该反应是反应前后气体体积不变的反应,无论反应是否平衡,气体的压强不变,因此不能根据压强不再变化判断反应是否处于平衡状态,A错误;
B.根据v(A)正=2v(B)逆可得v(A)正= v(A)逆,反应处于平衡状态,B正确;
C.该反应在反应前后气体的质量会发生变化,由于容器的容积不变,所以若气体密度不再变化,反应达到平衡状态,C正确;
D.若反应未达到平衡,A的质量就会发生变化,因此若A的百分含量保持不变,说明反应达到平衡状态,D正确;
E.根据方程式可知,每反应消耗2mol A,就会同时产生3mol C,若A的消耗速率与C的消耗速率之比为2:3,则会产生2mol A,反应达到平衡,现在A的消耗速率与C的消耗速率之比为2:1,说明反应未达到平衡状态,E错误;
故合理选项是BCD;
II.(1)电极活动性:Al>Ag2O,所以Ag2O为电池的正极,Al为负极,负极Al失去电子变为Al3+,与溶液中的OH-反应产生AlO2-,所以负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O。
(2)Al是+3价的金属,每有1mol Al反应,转移3mol电子,所以当有 1mol电子流经外电路时,负极质量减少了![]() =9g。
=9g。
(3)根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的 OH-向正电荷较多的负极Al电极迁移。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是

A. 装置A气密性的检查方法:直接向长颈漏斗中加水,当漏斗中液面高于试管中液面且高度不变说明气密性良好
B. 装置B中盛放硅胶,目的是除去A中挥发出来的少量水蒸气
C. 装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D. 装置A也可直接用于Cu与浓硫酸反应制取SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式_________________________________。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是________________________,B在反应中表现出的性质是_______、______。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式________;实验室检验C的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Y是一种抗氧化剂,它的一种合成路线如下图所示:
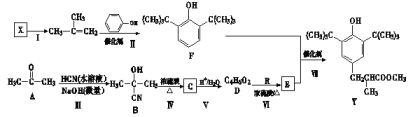
已知:![]()
回答下列问题:
(1)反应Ⅲ的类型是___________。
(2)Y具有的含氧官能团名称是__________和___________;有机物R的结构简式为_____________;若反应I为消去反应且X分子含3个甲基,则X可能的名称是_______________________。
(3)在一定条件下E能通过聚合反应合成功能高分子材料。写出该反应的化学方程式:_______________________________________________。
(4)G是F的同分异构体,G同时具备下列条件的结构有________种。
①芳香族化合物且与氯化铁溶液发生显色反应;
②苯环上有3个取代基;
③苯环上一氯代物只有2种。
其中,在核磁共振氢谱图中共有4组峰,且峰面积比为1∶1∶2∶18的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含氧有机化合物可以作为无铅汽油的抗爆震剂,其相对分子质量为88.0,含C的质量分数为0.682,含H的质量分数为0.136。
(1)试确定该化合物的分子式___。
(2)经红外光谱和核磁共振氢谱显示该分子中有4个甲基。请写出其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四支试管中发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,生成气体的速率最大的是( )
试管 | 温度/℃ | 等质量的CaCO3的形状 | 盐酸浓度/mol.L-1 |
A | 20 | 块状 | 0.5 |
B | 20 | 块状 | 1.0 |
C | 40 | 块状 | 1.0 |
D | 40 | 粉末 | 1.0 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A. 有机化合物中每个碳原子最多形成4个共价键
B. 乙烯能使酸性高锰酸钾溶液和溴水褪色,但二者反应原理不相同
C. 在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
D. 乙烯和苯均能发生氧化反应,说明乙烯和苯分子中均有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。

主要实验步骤如下:①按图组装仪器,并检验装置的气密性;
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的U型管的质量,得到bg;
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止;
⑤从导管A处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的U型管的质量,得到c g;
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g。
请回答下列问题:
(1)用托盘天平称量药品时,如果天平的指针向左偏转,说明______。
(2)图中装置中干燥管B的作用是_____。
(3)如果将分液漏斗中的硫酸换成浓度相同的足量盐酸,测试的结果____(填偏高、偏低或不变)。
(4)步骤⑤的目的是________。
(5)试样中纯碱的质量分数的计算式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com