
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。

(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,试写出此反应的化学方程式_________________________________。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式是________________________,B在反应中表现出的性质是_______、______。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,试写出此反应的化学方程式________;实验室检验C的方法___________。
【答案】C+2H2SO4(浓)![]() CO2↑+ 2H2O + SO2↑ 2NO3-+ 3Cu + 8H+ = 2NO↑+ 4H2O + 3 Cu 2+ 酸性 氧化性 2NH4Cl+ Ca(OH)2
CO2↑+ 2H2O + SO2↑ 2NO3-+ 3Cu + 8H+ = 2NO↑+ 4H2O + 3 Cu 2+ 酸性 氧化性 2NH4Cl+ Ca(OH)2![]() CaCl2 +2NH3↑+2H2O 把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气。(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气。)
CaCl2 +2NH3↑+2H2O 把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气。(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气。)
【解析】
A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,则E为H2O,
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,则A是碳,B是硫酸;
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A是铜,B是硝酸,B在反应中表现出的性质是酸性、氧化性;
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,则C是氨气,据此答题。
(1)若A是一种黑色单质,B是一种常见的难挥发性酸,C、D都是气体,则A是碳,B是硫酸,此反应的化学方程式是C+2H2SO4(浓)![]() CO2↑+2H2O+SO2↑,故答案为:C+2H2SO4(浓)
CO2↑+2H2O+SO2↑,故答案为:C+2H2SO4(浓)![]() CO2↑+2H2O+SO2↑。
CO2↑+2H2O+SO2↑。
(2)若A是一种紫红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A是铜,B是硝酸,反应的离子方程式是2NO3-+3Cu+8H+=2NO↑+4H2O+3Cu2+,B在反应中表现出的性质是酸性、氧化性,故答案为:2NO3-+3Cu +8H+ =2NO↑+4H2O +3Cu 2+,酸性,氧化性。
(3)若实验室中利用A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小的气体,则C是氨气,此反应的化学方程2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;实验室检验C的方法把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;实验室检验C的方法把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;实验室检验C的方法把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气)。
CaCl2+2NH3↑+2H2O;实验室检验C的方法把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气)。


科目:高中化学 来源: 题型:
【题目】同温同压下,已知下列各反应为放热反应,下列各热化学方程式中焓变数值最小的是( )
A.2A(l)+B(l)=2C(g) ΔH1B.2A(g)+B(g)=2C(g) ΔH2
C.2A(g)+B(g)=2C(l) ΔH3D.2A(l)+B(l)=2C(l) ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α射线是由α粒子组成,α粒子是一种没有核外电子的粒子,它带有2个单位的正电荷,它的质量数等于4,由此可推断α粒子含有____个质子,______个中子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验:
(1)若要比较镁、铝的金属性强弱,下列方案可行的是:____________(填序号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将等量的这两种元素的单质粉末分别与同浓度的盐酸反应
c.将这两种元素的单质粉末分别与热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(2)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?_________;说明理由:______________________________________________。
(3)利用如图装置(夹持装置省略)可以验证部分元素的非金属性强弱。
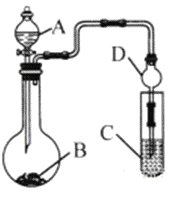
①实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请在其中选择合适药品设计实验验证氯的非金属性大于硫,烧瓶中发生反应的化学方程式为:_____________________________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为:_____________________________。
②若要自选药品证明非金属性:C>Si,则A中加__________、B中加Na2CO3粉末、C中加_____________,观察到C中溶液的现象为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
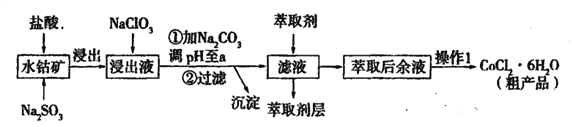
已知:①浸出液含有的阳离子主要有,H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe( OH)3 | Fe(OH)2 | Co(OH)2 | Al( OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)①浸出过程中加入Na2SO3的目的是____。
②向浸出液中加入NaClO3的离子反应方程式为____。
③为提高浸取率除了适当增大NaClO3浓度,升高温度还可采取措施____(答一条即可)。若不慎向“浸出液”中加入NaClO3过量时,可能会生成有毒气体,写出生成该有毒气体的离子方程式____。
(2)①“加Na2CO3调pH至a”,过滤所得到的沉淀成分为____。
②萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____;其使用的适宜pH范围是____(填编号)。
A.2.0—2.5 B. 3.0—3.5 C.4.0—4.5 D.5.0—5.5

③“操作1”中包含的基本实验操作,它们依次是_______、____和过滤、减压烘干。
(3)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤,洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____(答一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 向银氨溶液中滴加乙醛:CH3CHO+2[Ag(NH3)2]++H2O![]() CH3COO+2H++2Ag↓+3NH3↑+
CH3COO+2H++2Ag↓+3NH3↑+![]()
B. 苯酚钠溶液中通入少量CO2:![]() +H2O+CO2
+H2O+CO2![]()
![]() +
+![]()
C. 硫酸氢铵溶液中滴加少量NaOH溶液:H++![]() +2OH
+2OH![]() NH3·H2O+H2O
NH3·H2O+H2O
D. 氯乙酸与足量的氢氧化钠溶液共热:CH2ClCOOH+OH![]() CH2ClCOO+H2O
CH2ClCOO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____ mol/(L·s)。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A.压强不再变化 B.v(A)正=2v(B)逆
C 气体密度不再变化 D.A的百分含量保持不变
E.A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”),负极反应式为______。
(2)当有 1mol电子流经外电路时,负极质量减少______g。
(3)溶液中的 OH-向________极迁移(填“Ag2O”或“Al”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
第2周期 | ① | ② | ||||||
第3周期 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素⑥的原子结构示意图___________;写出⑤的氧化物的一种用途__________。
(2)表中⑤和⑥气态氢化物的稳定性顺序为 ______ >______(填氢化物的化学式);
(3)表中能形成两性氢氧化物的元素是_________(填元素符号),该元素的单质与③的氢氧化物水溶液反应的离子反应方程式_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com