
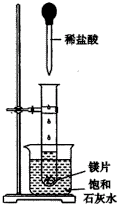
 如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列回答:

科目:高中化学 来源: 题型:
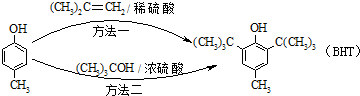
A、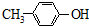 能与Na2CO3溶液反应 能与Na2CO3溶液反应 |
B、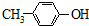 与BHT互为同系物 与BHT互为同系物 |
| C、BHT久置于空气中会被氧化 |
| D、两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
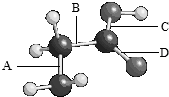 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸式滴定管未用待装溶液润 |
| B、碱式滴定管未用待装溶液润洗 |
| C、滴定前平视滴定管刻度线,滴定终了仰视刻度线 |
| D、在滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蔗糖水解只生成葡萄糖 |
| B、含有碳碳双键的有机物均存在顺反异构现象 |
| C、向混有苯酚的苯中加入金属Na有无色气体生成 |
| D、用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基放电充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+、K+、SCN-、SO42- |
| B、Fe3+、Fe2+、H+、S2- |
| C、Mg2+、Fe2+、OH-、NO3- |
| D、Na+、Fe3+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 1 mol?L-1的氯化铁溶液中铁离子的数目为NA |
| B、标准状况下,2.24L CH2Cl2含有的分子数为0.1NA |
| C、78g Na2O2固体与足量H2O反应转移的电子数为NA |
| D、t℃时,1L pH=6的纯水中OH-的数目为10-8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | E |
| A、若C的最高价氧化物的水化物为强酸,则D元素肯定是活泼的非金属元素 |
| B、若A(OH)n为强碱,则B(OH)m也一定为强碱 |
| C、若C的最高正化合价为+5价,则A一定为金属元素 |
| D、若D的最低负化合价为-2价,则E的最高正价为+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ① | ③ | ④ | ⑧ | ⑨ | |||
| 4 | ② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com