
【题目】硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI;Ⅱ.2HI![]() H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
H2+I2 ;Ⅲ.2H2SO4===2SO2+O2+2H2O。
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)![]() 2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
2HI(g)的平衡常数K=________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。

a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4
c.Na2SO4 d.NaHSO3
【答案】c0.1 mol·L-1·min-164b向右b
【解析】
(1)反应Ⅲ在常温下向左进行,故a项错误,;SO2的还原性比HI强,故b项错误;根据盖斯定律Ⅰ×2+Ⅱ×2+Ⅲ得总反应:2H2O===2H2+O2,循环过程中消耗了H2O ,故c项正确;根据总反应知产生1 mol O2的同时产生2 mol H2,故d项错误;答案选C。(2)由题干数据分析该反应:
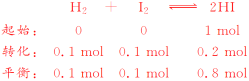
0~2 min内平均反应速率v(HI)=![]() =0.1 mol·L-1·min-1,
=0.1 mol·L-1·min-1,
平衡常数K=![]() =64,若开始加入HI的物质的量是原来的2倍,相当于先将HI加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为等体积反应,加压平衡不移动,所以HI的浓度为原来的2倍,H2的体积分数不变,温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短;故答案为:0.1 mol·L-1·min-1、64、b;(3)Zn与稀H2SO4反应,c(H+)减小,水的电离平衡向右移动;若向原溶液中加入NaNO3,Zn与H+、NO
=64,若开始加入HI的物质的量是原来的2倍,相当于先将HI加入到2 L的容器(达到的平衡状态与原平衡一致,即HI的浓度、H2的体积分数与原平衡相同),再将体积压缩至1 L,因为该反应为等体积反应,加压平衡不移动,所以HI的浓度为原来的2倍,H2的体积分数不变,温度不变,平衡常数不变;加入HI的物质的量增大,反应物浓度增大,反应速率加快,达到平衡的时间缩短;故答案为:0.1 mol·L-1·min-1、64、b;(3)Zn与稀H2SO4反应,c(H+)减小,水的电离平衡向右移动;若向原溶液中加入NaNO3,Zn与H+、NO![]() 反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO
反应不生成H2;若加CuSO4,Zn+CuSO4===ZnSO4+Cu,Zn与Cu构成原电池,加快反应速率;若加Na2SO4,对反应速率没有影响;若加NaHSO3,HSO![]() 消耗H+生成H2O和SO2,反应速率减小;故答案为:向右、b。
消耗H+生成H2O和SO2,反应速率减小;故答案为:向右、b。


科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合后发生反应:SO2(g)+NO2(g) ![]() NO(g) +SO3(g)在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”),NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
NO(g) +SO3(g)在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”),NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
(2)①碳酸钾溶液蒸干得到的固体物质是____________ ,原因是______________________;
②碳酸氢钡溶液蒸干得到的固体物质是____________ ,原因是______________________。
(3)请用离子方程式表示泡沫灭火器(成分:NaHCO3、Al2(SO4)3)的灭火原理:___________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH)=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(5)若常温下取0.2 mol·L-1MOH溶液与0.1 mol·L-1盐酸等体积混合,测得混合溶液的pH < 7,说明MOH的电离程度___________(填“>”、“<”或“=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )

A. 当M为CuSO4、杠杆为导体时,A端低,B端高
B. 当M为AgNO3、杠杆为导体时,A端高,B端低
C. 当M为盐酸、杠杆为导体时,A端高,B端低
D. 当M为CuSO4、杠杆为绝缘体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3·H2O![]() NH+OH-,如想增大NH的浓度,而不增大OH-的浓度,应采取的措施是
NH+OH-,如想增大NH的浓度,而不增大OH-的浓度,应采取的措施是
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸
A. ①② B. ②③ C. ①④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯离子插层镁铝水滑石![]() 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为![]() 、
、![]() 、
、![]() 和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。
和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。

(1)![]() 热分解的化学方程式为______________________。
热分解的化学方程式为______________________。
(2)若只通过测定装置C、D的增重来确定![]() ,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
(3)加热前先通过![]() 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入![]() 的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
(4)完全分解后测得C增重3.65g 、D增重9.90g ,则![]() =_____________,若取消冷却玻管B后进行试验,测定
=_____________,若取消冷却玻管B后进行试验,测定![]() 值将______________(填“偏高”或“偏低”)。
值将______________(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
A. c(OH-)=10-2mol·L-1
B. 加入少量NaOH固体,c(Na+)和c(CO32-)均增大
C. c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D. 2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如下图,下列说法错误的是

A. “PX”的二氯代物共有6种(不考虑立体异构) B. “PX”的分子式为C8H10
C. “PX”分子中,最多有14个原子共面 D. 可用酸性KMnO4溶液鉴别“PX”与苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com