
����Ŀ��ij��A����Է�������Ϊ84���ش��������⣺
��1������������A�����������ϣ��������ʵ���һ�������ȼ������������������ȵ���(�����)________��
a��C7H12O2 b��C6H14 c��C6H14O d��C7H14O3
��2��������A���������е�̼ԭ�ӹ�ƽ�棬��A�Ľṹ��ʽΪ_____________��
��3�����˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ3��2��1���Ҳ�����˳���칹�壬��A������Ϊ_____��
��4����A����ʹ��ˮ��ɫ������һ�ȴ���ֻ��һ�֣���A�Ľṹ��ʽΪ__________��
���𰸡�b ![]() 2-�һ�-1-��ϩ
2-�һ�-1-��ϩ ![]()
��������
��A����Է�������Ϊ84�����������Ϊϩ��������������ʽӦΪC6H12��
��1�������ʵ���һ�������ȼ������������������ȣ�1molC6H12��������Ϊx+![]() =9mol��
=9mol��
a��1molC7H12O2��������Ϊ9mol�������ʵ���һ�������ȼ����������������ȣ���a��ѡ��
b��1molC6H14��������Ϊ9.5mol�������ʵ���һ�������ȼ������������������ȣ���bѡ��
c��1molC6H14O��������Ϊ9mol�������ʵ���һ�������ȼ����������������ȣ���c��ѡ��
d��1molC7H14O3��������Ϊ9mol�������ʵ���һ�������ȼ����������������ȣ���d��ѡ��
�ʴ�Ϊ��b��
��2����AΪ���������������е�̼ԭ����ͬһƽ���ϣ��÷��ӵ�һ��ȡ����ֻ��һ�֣���ṹ�Գƣ�ֻ��һ��H������4������AΪ![]() ��
��
��3���˴Ź���������ʾ����A�����鲻ͬ�ķ壬�������Ϊ3��2��1����AΪCH2=C��CH2CH3��CH2CH3������Ϊ2-�һ�-1-��ϩ��
��4��A����ʹ��ˮ��ɫ������һ�ȴ���ֻ��һ�֣���C=C��ֻ��һ��H��ӦΪ��������ṹ��ʽΪ![]() ��
��


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��װ�ý���ʵ�飬ʵ��һ��ʱ���������Ԥ�ⲻһ�µ���

�������� | �������� | ʵ��Ԥ�� | |
A | Ũ��ˮ | ��̪��Һ | ������Һ��Ϊ��ɫ |
B | Ũ���� | ����KI��Һ | ������Һ��Ϊ��ɫ |
C | Ũ���� | Ũ��ˮ | ���ձ����а��� |
D | ���͵���������Һ | ϡ��ˮ | ���������Ա仯 |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ��������£�����ѡ������ʾ�����ʼ�ת����һ��ʵ�ֵ��ǣ� ��
A.Fe![]() Fe2O3
Fe2O3![]() Fe(OH)3B.Mg(OH)2
Fe(OH)3B.Mg(OH)2![]() MgCl2��Һ
MgCl2��Һ![]() Mg
Mg
C.NH3![]() NO
NO![]() NO2D.SO2
NO2D.SO2![]() (NH4)2SO4
(NH4)2SO4![]() BaSO4
BaSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Դֹ�(���衢���)Ϊԭ����ȡ���Ȼ��裨SiCl4����װ��ʾ��ͼ���£�
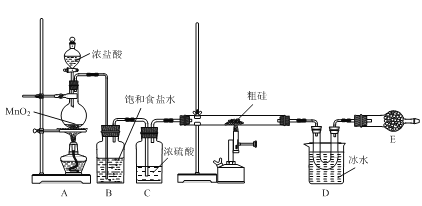
��֪����SiCl4��ˮ��Ӧ��BCl3��SiCl4���ܡ�
�ڸ����¹衢����������Ӧ���������ʵIJ������������
���� | SiCl4 | BCl3 |
�е�/�� | 57.7 | 12.8 |
�۵�/�� | -70.0 | -107.2 |
��1��װ��A��ʢװŨ���������������___��
��2����ʪ��ĵ���KI��ֽ���Լ���Cl2��д����ʾ�÷�Ӧԭ�������ӷ���ʽ��___��
��3��װ��B�б���ʳ��ˮ��������___��
��4��װ��D���ռ��������ʣ�����___���������������SiCl4��
��5��װ��E��Ӧװ����Լ�������___����������___��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��ϳɵ���Ҫ������ij�������к���������Ʒ(��Ҫ�ɷ����������������������ʼ��仯�����������������)��ijѧϰС����������������ú���������Ʒ�Ʊ����������壺
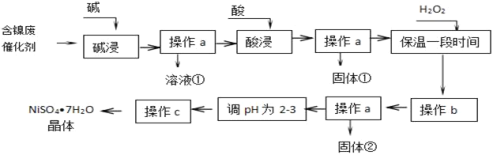
�������ܼʼ��������ȫ������pH��
�ش��������⣺
(1)��Һ���к�����Ԫ�ص�������_________��
(2)�����ӷ���ʽ��ʾ����˫��ˮ��Ŀ��______________��˫��ˮ���������������������_________
A.���� ![]() Ư��Һ
Ư��Һ ![]() ����
���� ![]() ���
���
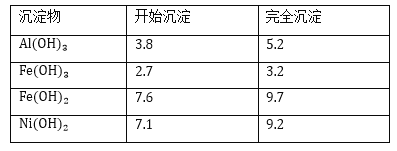
(3)����b������ҺpH��ΧΪ______________��
(4)����a��c��Ҫ��ͬ�IJ���������_______�����������У���ֹŨ���ᾧ�����У�Ni2+ˮ��Ĵ�ʩ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 mL Al2(SO4)3��Һ�У���Al3��Ϊ1.62 g���ڸ���Һ�м���0.1 mol��L��1Ba(OH)2��Һ300 mL(������Һ����仯)����Ӧ����Һ��SO42-�����ʵ���Ũ��Ϊ
A.0.4 mol��L��1B.0.1 mol��L��1C.0.2 mol��L��1D.0.3 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֽྻ������������Դ����������(��Ҫ�ɷ�ΪCO��CO2��)��H2��ϣ����ϳɼ״��������������õķ���֮һ��
(1)������Ӧ�Ĵ�������Cu��Zn��Al��Ԫ�ء�д����̬Znԭ�ӵĺ�������Ų�ʽ��________��
(2)���ݵȵ���ԭ����д��CO���ӵĽṹʽ__________��
(3)�״��������ɵõ���ȩ����ȩ������Cu(OH)2�ļ�����Һ��Ӧ����Cu2O������
�ټ�ȩ������̼ԭ�ӹ�����ӻ�����Ϊ_______________��
�ڼ�ȩ���ӵĿռ乹����___________��1 mol��ȩ��������������ĿΪ______________��
����1��Cu2O����(�ṹ��ͼ��ʾ)�У���������Cuԭ����ĿΪ______________��
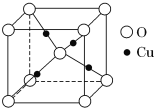
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������㷺�����ڶ�ֲ�����ڣ�����������������˵����ȷ����
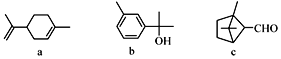
A. a��b�����ڷ����廯����
B. a��c����������̼ԭ�Ӿ�����ͬһƽ����
C. a��c����ʹ����KMnO4��Һ��ɫ
D. b��c���������Ƶ�Cu(OH)2��Ӧ���ɺ�ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����ʱ䣨��H�����������ж��д������

A. 2NO(g)��2CO(g)=N2(g)��2CO2(g)�ڳ��������Է����У���÷�Ӧ�� ��H��0
B. 500 ����30 MPa�£�0.5 mol N2��1.5 mol H2��ַ�Ӧ�ų� 19.3 kJ ��������Ӧ��N2(g)��3H2(g) ![]() 2NH3(g)���� ��H����38.6 kJ��mol-1
2NH3(g)���� ��H����38.6 kJ��mol-1
C. ����ͼ1 ֪����H1 = ��H2+��H3
D. ����ͼ2 ֪��E�Ĵ�С�Ը÷�Ӧ����H ��Ӱ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com