
����Ŀ��������(AlN)��һ���������ǽ������ϣ�Ϊ�˷���ijAlN��Ʒ����Ʒ�е����ʲ���NaOH��Һ��Ӧ����AlN�ĺ�����ijʵ��С���������������ʵ�鷽������֪��AlN+NaOH+H2O=NaAlO2+NH3��
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
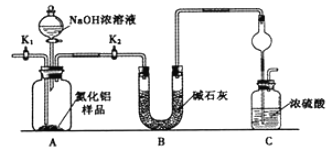
��1����ͼCװ�������θ���ܵ�������________________________��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã����ȼ��װ�õ������ԣ��ټ���ʵ��ҩƷ����������ʵ�������________����Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����_______________��
��3����������װ�û�����ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����_________________��
������2�������²���ⶨ��Ʒ��A1N�Ĵ��ȣ�
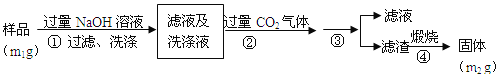
��4�����������ɳ��������ӷ���ʽΪ___________________��
��5���������IJ�����__________��A1N�Ĵ�����___________����m1��m2��ʾ����
���𰸡���ֹ�����ر�K1����K2��װ���в����İ���ȫ������Cװ��Cװ�ó��ڴ�����һ������װ��CO2+AlO2-+2H2O=HCO3-+Al(OH)3�����ˡ�ϴ��![]()
��������
�����������
����֪��AlN+NaOH+H2O=NaAlO2+NH3��������1����ʵ����ͨ�����������뵪������Ӧ������������ͨ���ⶨ���������ﵽ����AlN���ȵ�Ŀ�ģ�AΪAlN��NaOH��Һ��Ӧװ�ã�BΪ���ﰱ��װ�ã�CΪ���հ���װ�á�����2��AlN��NaOH��Һ��Ӧ��ͨ����NaAlO2ת��ΪAl(OH)3����ת��Ϊ��������ͨ���ⶨ��������������������AlN���ȡ�
��1�����θ��������ռ�������������������ã�
��2����װ��ʵ��װ�ã����ȼ��װ�õ������ԣ��ټ���ʵ��ҩƷ����Ӧ�������ȹر�K1����K2�������ɵİ��������ʯ�Ҹ���ٱ�Ũ�������գ���Ӧ��ɺ�K1ͨ�뵪����Ŀ���ǰ�װ���в����İ���ȫ������Cװ�ã���֤ʵ���ȷ�ԣ�
��3����װ�ô���C���ܻ����տ�����ˮ������ȱ�ݣ�Ϊ��ֹC��������ˮ�������Cװ�ó��ڴ�����һ������װ�á�
��4����Һ����AlO2����ͨ�������CO2������������������ CO2��AlO2����2H2O��HCO3����Al(OH)3��
��5�����ɵ�Al(OH)3���������˺�����Һ���룬�پ�ϴ�ӵõ������Ĺ��壬�ٽ������ȷֽ�õ�Al2O3��ͨ��
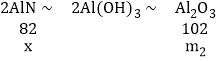
���x=![]() ������Ʒ����m1�Ƚϵõ� A1N�Ĵ����� ��
������Ʒ����m1�Ƚϵõ� A1N�Ĵ����� �� ![]() ��100% ��
��100% ��


 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���̶�������CO2����Ч��������Դ�������ٿ����е��������壮��ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g����H=-49.0kJ��mol-1��ij��ѧʵ�齫6mol CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ1��ʾ��ʵ������ͼ������a��1��6����������˼�ǣ���1minʱH2�����ʵ�����6mol��
CH3OH��g��+H2O��g����H=-49.0kJ��mol-1��ij��ѧʵ�齫6mol CO2��8mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼ1��ʾ��ʵ������ͼ������a��1��6����������˼�ǣ���1minʱH2�����ʵ�����6mol��
��a������Ӧ����____________������ڡ����ڻ�С�����淴Ӧ������
������ʱ���ƽ����Ӧ����������__________����С����__________��
A��0��1min B��1��3min C��3��8min D��8��11min
�����ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı���__________����������Ӧ��ʵ�������ı���__________��
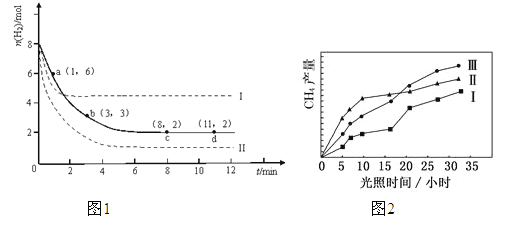
��2�����ù��ܺ�������ɽ� CO2�� H2O��g��ת��Ϊ CH4�� O2�����������ʱ���ڲ�ͬ�����������������������£�CH4���������ʱ��ı仯��ͼ��ʾ����0��30Сʱ�ڣ�CH4��ƽ���������� v����v����v���Ӵ�С��˳��Ϊ____________����Ӧ��ʼ���12Сʱ�ڣ��ڵ�__________�ִ��������£��ռ��� CH4��ࡣ
��3�� 1100 ��ʱ�����Ϊ2L�ĺ��������з������·�Ӧ��
Na2SO4��s��+4H2��g��![]() Na2S��s��+4H2O��g�����������жϷ�Ӧ�ﵽƽ��״̬����__________��
Na2S��s��+4H2O��g�����������жϷ�Ӧ�ﵽƽ��״̬����__________��
A������������ѹǿ���ٱ仯
B��H2������������ٱ仯
C��lmolH--H������ͬʱ2molH--O���γ�
D��Na2S���������ٱ仯
E��v����H2��=v����H2O��
F.�����������ܶȲ��ٱ仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��ǿ�������Һ����������һ�������������Һ��ǿ
B��������������ʣ�ͭ��ǿ�����
C������������ǿ����ʣ��������������
D����������ǿ����ʣ����ᱵ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ���У���ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����Բ���������Ϊ����֤�ס�����λͬѧ���ж��Ƿ���ȷ����ͬѧ�������ͼ��ʾʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX���Ҹ�װ����ȥ����ϴ��ƿ�и��������Һ���������Իش�
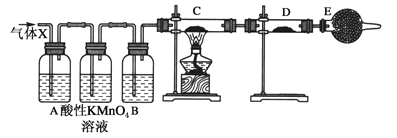
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ��__________________��
��2����ͬѧ��Ϊ�����ܲ��������������ǣ�_____________________��
��3����ͬѧ�ڰ�װ��װ�úز����ٵ�һ�������ǣ�________________��
��4��A�м�����Լ�������____________��������_______________��B�м�����Լ�������________��������_____________��E�м�����Լ�������_____________��������________________��
��5������֤������X�к���������ʵ�������ǣ�C�У�______________��D�У�_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A���������ײ��������ѧ��Ӧ
B�������¶Ȼ��ӿ���Ӧ����������Ҫԭ��������������������ײ�Ĵ���
C���������μ�����ѧ��Ӧ������ѹǿ��������������������Ӷ�ʹ��Ӧ��������
D������Ӽ����ײ��һ������Ч��ײ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ�����
��1�������Ǵ�ͳ�Ľ��ա�����ص����ǻ�������ֽ�ͨ���ؼ���������Բ��
�� �����������ʿ���������ɻ���̥����Ҫ������ ������ĸ����
a�����Ͻ� b���� c������
�� ��·����Ҫ�Ľ�ͨ���ߡ�������·��Ҫ����ˮ�ࡣ��ҵ������ˮ�����Ҫԭ����ʯ��ʯ�� ������ĸ����
a����� b������ c��ʯӢ
�� �ִ�Ҳ����Ҫ�Ľ�ͨ���ߡ�Ϊ�����ְ岻�ܸ�ʴ���ڴ�β�ְ�����Ƕ�Ľ������� ������ĸ����
a��ͭ�� b��п�� c������
��2��������ڼ��ۻ�Ҫע����ʳ��������֤���彡����
��ƽʱҪ���ˮ��ˮ������������Ҫ���������ܡ����������������п���ˮ����� ������ĸ��
a�������� b�������� c����֬
������ѡ����ʳ������Ѽ���������dz���ʳ�ģ����Ǹ�����Ӫ����������֬�� ���������۵�������ٽ��ˣ����۵Ļ�ѧʽ�� ���߲˺�ˮ������ά����C�����������������ҽ��ά����CƬ����ҩƬ�����һ�����������������ó��˸��ƿڸ��⣬����Ҫ�������� ��
����֭�Ǽ���ij�����Ʒ��ijƷ�Ƴ�֭�к��а�ɰ�ǡ������Ρ����ʻƺͱ������ƣ��⼸��������������ɫ������ ��
����ʳ����������θʹ��θ��ƽ[��Ҫ�ɷ���Al��OH��3]������θ�������д��Al��OH��3��θ�ᷴӦ�����ӷ���ʽ ��
��3�������ڼ䣬������������������ʱҪ��������������������
����������Ǽ��ճ��е�������������ı�����Ϊ2015��Ƽ��ȴʡ��϶��ŷ��������岻����������ֵ��� ������ĸ����
a��N2 b�� NO2 c��CO2
���ù��ľ���ϩ����ʳƷ��ҪͶ�����пɻ������־���������С�����ϩ�Ľṹ��ʽ�� ��
��˽�ҳ����������δ������㣬�����¡���Ⱦ���ɻرܡ�����β���е�CO��NO2�������������¿�ת��Ϊ�������ų����仯ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ǿ����ǿ���ϡ��Һ�����кͷ�Ӧ���Ȼ�ѧ����ʽΪ H��(aq)��OH��(aq)=H2O(l) ��H����57.3 kJ��mol��1����֪����ʵĵ��������ȹ��̡���1 L 0.5 mol��L��1��NaOH��Һ�м����������ʣ���ϡ�����Ũ�����ϡ���ᣬǡ����ȫ��Ӧ�������ʱ���H1����H2����H3�Ĺ�ϵ��( )
A. ��H1>��H2>��H3 B. ��H1<��H3<��H2
C. ��H1����H3>��H2 D. ��H1>��H3>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���Fe3+��Cu2+��Ag+�������ӣ�ij�о�С����ƵĴ����������£���������������Լ�����������
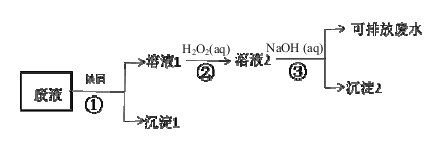
��1������1����Ҫ�ɷ���_________����Ԫ�ط��ű�ʾ��������2��ѧʽΪ___ ___��
��2��������������Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����������������й㷺Ӧ�ã���ش��������⣺
��1��������FeS2�������������ұ����������Ҫԭ�ϣ�����һ����ӦΪ3FeS2+8O2![]() 6SO2+Fe3O4���÷�Ӧ����������Ϊ________������3mol FeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______��
6SO2+Fe3O4���÷�Ӧ����������Ϊ________������3mol FeS2�μӷ�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______��
��2��FeCl3������ᷴӦʱ��������ɫ���ʣ��÷�Ӧ�����ӷ���ʽΪ_________��
��3����һ������Fe2O3����160mL 5molL��1�����У��ټ���һ�������ۣ�����ǡ����ȫ�ܽ⣬�ռ�������2.24L����״����������⣬��ҹ����Fe3+����μӷ�Ӧ�����۵�����Ϊ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com