
【题目】(1)用系统命名法对下列有机物进行命名
① _____________________________________________
_____________________________________________
② ____________________________________________
____________________________________________
③写出分子式为C4H8的所有烯烃的结构简式及名称。_______________________________________
(2)下列几种烃类物质:

 环辛四烯
环辛四烯
①正四面体烷的二氯取代产物有________种;立方烷的二氯取代产物有________种。
②关于苯和环辛四烯的说法正确的是________(填字母符号)。
A.都能使酸性KMnO4溶液褪色
B.都能与H2发生加成反应,等质量的苯和环辛四烯消耗H2的物质的量之比为3:4
C.都是碳碳单键和碳碳双键交替结构
D.都能发生氧化反应
③乙烯基乙炔含有的官能团名称是______________________________。
(3)根据下列有机化合物填空。
a.  b.
b. 
①a中所含官能团的名称是_________________________________________________;
②b中所含官能团的结构简式是__________________________________________。
(4)测定实验式:某含C、H、O三种元素的有机物,经燃烧实验测得其碳的质量分数为64.86%,氢的质量分数为13.51%,则其实验式是____。
【答案】2-甲基戊烷 2-甲基-1-丁烯 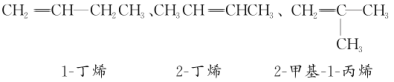 1 3 D 碳碳双键、碳碳三键(或碳碳叁键) 羟基、羧基
1 3 D 碳碳双键、碳碳三键(或碳碳叁键) 羟基、羧基 ![]() 、
、![]() 、—OH C4H10O
、—OH C4H10O
【解析】
(1)烷烃中以含碳最多的碳为主碳链,支链在主链上位次最小;不饱和烃中,以含有碳碳双键在内的最长碳链为主碳链,支链位次最小进行命名;据以上分析解答。
(2)①根据正四面体烷二氯代物的种类取决于一氯代物中氢原子的种类;立方烷的二氯代物取决于一氯代物中氢原子的种类;
②苯不含碳碳双键,性质较为稳定,与高锰酸钾不反应,环辛四烯含有碳碳双键,具有烯烃的性质;
③根据乙烯基乙炔结构简式写出含有的官能团名称;
(3)①根据a的结构简式写出a中所含官能团名称;
②根据b的结构简式写出b中所含官能团结构简式;
(4)根据有机物的元素组成可求出氧元素的质量分数,然后计算出分子中C、H、O三种元素的个数比,进而求出其实验式。
(1)①该烃为烷烃,主碳链为5,为戊烷,2位碳上有1个甲基,因此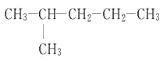 名称为:2-甲基戊烷;综上所述,本题答案是:2-甲基戊烷。
名称为:2-甲基戊烷;综上所述,本题答案是:2-甲基戊烷。
②该烃为烯烃,包含双键在内的主碳链为4,双键在1位碳上,2位碳上有1个甲基,因此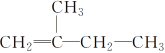 名称为:2-甲基-1-丁烯;综上所述,本题答案是:2-甲基-1-丁烯。
名称为:2-甲基-1-丁烯;综上所述,本题答案是:2-甲基-1-丁烯。
③烯烃含有碳碳双键,分子式为C4H8的所有烯烃的结构简式及名称分别为:
CH2=CH-CH2CH3 ,名称为1-丁烯;CH3CH=CHCH3,名称为2-丁烯;CH2=C(CH3)2,名称为2-甲基-丙烯;综上所述,本题答案是:CH2=CH-CH2CH3 1-丁烯 ,CH3CH=CHCH3,2-丁烯CH2=C(CH3)2 2-甲基-1-丙烯。
(2)①正四面体烷完全对称,只有一种氢原子,一氯代物只有1种,一氯代物中氢原子也只有1种,所以故二氯代物只有1种;立方烷分子中只有一种氢原子,其一氯代物有1种,而一氯代物有3种氢原子,分别在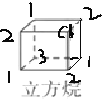 ,则立方烷的二氯代物有3种;综上所述,本题答案是:1;3。
,则立方烷的二氯代物有3种;综上所述,本题答案是:1;3。
②A.苯性质稳定,与酸性KMnO4溶液不反应,故A错误;
B.最简式相同,都能与氢气发生加成反应,等质量的苯和环辛四烯消耗氢气的物质的量之比为1:1,故B错误;
C.苯不是碳碳单键和碳碳双键交替结构,故C错误;
D.两种有机物都可燃烧,都能发生氧化反应,故D正确。
综上所述,本题选D。
③根据乙烯基乙炔的结构简式可知,含有的官能团是碳碳双键、碳碳三键(或碳碳叁键);综上所述,本题答案是:碳碳双键、碳碳三键(或碳碳叁键)。
(3)①根据a的结构简式可知,a中所含官能团是:羟基、羧基;综上所述,本题答案是:羟基、羧基。
②根据b的结构简式可知,b中所含官能团的结构简式分别是:![]() 、
、![]() 、—OH ;综上所述,本题答案是:
、—OH ;综上所述,本题答案是:![]() 、
、![]() 、—OH 。
、—OH 。
(4)碳的质量分数是64.86%,氢的质量分数是13.51%,氧元素质量分数是1-64.86%-13.51%=21.63%,则该物质中碳、氢、氧原子个数之比=64.86/12:13.51/1:21.63/16=4:10:1,所以其实验式为:C4H10O;综上所述,本题答案是:C4H10O。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
NaCl溶于水 |
电解CuCl2溶液 |
CH3COOH在水中电离 |
H2与Cl2反应能量变化 |
NaCl | CuCl2 | CH3COOH | H2(g)+Cl2(g) ΔH=183kJ·mol1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是

A. 反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B. 图中X点所示条件下,延长反应时间能提高NO转化率
C. 图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D. 380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种短周期元素,其中A,B,C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D,E原子核内各自的质子数与中子数相等;B元素可分别与A,C,D,E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为 7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:__________________________。
(2)写出AB2的结构式:___________________________________________________。
(3)B,C两元素的第一电离能大小关系为______>______(填元素符号),原因是____________________。
(4)根据VSEPR模型预测C的氢化物的立体构型为____________,中心原子C的杂化轨道类型为________。
(5)C的单质分子中π键的数目为______,B,D两元素的气态氢化物的稳定性大小关系为______>____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池可用于有机废水的处理,如图是利用微生物处理含尿素[CO(NH2)2]废水的装置。下列说法中正确的是

A. 该装置外电路中箭头的方向代表电流的方向
B. M电极反应式为CO(NH2)2-6e-+H2O=CO2↑+6H++N2↑
C. 当有1mlH+通过质子交换膜时,N极消耗5.6LO2
D. 该处理工艺会导致废水酸性增强,仍旧不能直接排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如下图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。

(1)化合物SO2Cl2中S元素的化合价为__________。
(2)仪器D的名称是___________。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为_____________(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是_____________。
A 98%浓硫酸+Cu B 70%H2SO4+Na2SO3 C 浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为________、________、丁、_______、_________(用甲、乙、丙表示,可重复使用)。
(5)B装置中从a口通入冷水的作用是_________;C装置的作用是_______________。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为________。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为______________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。向FeI2、FeBr2的混合溶液中通入适量Cl2,溶液中某些离子的物质的量变化如下图所示。下列说法中,不正确的是

A. 还原性:I->Fe2+>Br-
B. 原混合溶液中FeBr2的物质的量为3mol
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 当通入3mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g ②(a+b)×189 g ③ (Vc-![]() ) mol ④
) mol ④![]() mol
mol
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2在Fe2+、Cu2+的存在下生成具有强氧化性的OH(羟基自由基),OH可将有机物氧化降解。
(1)Cu2+H2O2体系中存在下列反应:
Cu2+(aq)+H2O2(aq)═CuOOH+(aq)+H+(aq)△H1=a kJmol﹣1
CuOOH+(aq)═Cu+(aq)+OH(aq)+1/2O2(g)△H2=b kJmol﹣1
2CuOOH+(aq)═2Cu+(aq)+H2O2(aq)+O2(g)△H3=c kJmol﹣1
则H2O2(aq)═2OH(aq)△H=_____kJmol﹣1。

(2)为探究温度对Cu2+H2O2甲基橙去除率的影响,某研究小组在不同温度下进行实验(其他条件相同),实验结果如图所示。相同条件下,温度升高,甲基橙去除速率增大,其原因是_____。
(3)为探究Fe2+Cu2+H2O2能够协同催化氧化降解甲基橙,某研究小组的实验结果如图所示。得出“Fe2+Cu2+H2O2催化氧化降解甲基橙效果优于单独加入Fe2+或Cu2+”结论的证据为_____。

实验条件:200 mL甲基橙模拟废水(1.5 gL﹣1,pH=3.0),温度60℃、V(H2O2)=2.0 mL
1﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0.4
2﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0.02:0
3﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0.4
4﹣V(H2O2):m(FeSO4):m(CuSO4)=2:0:0
(4)EFH2O2FeOx法可用于水体中有机污染物降解,其反应机理如下图所示。阳极的电极反应式为_____,X微粒的化学式为_____,阴极附近Fe2+参与反应的离子方程式为_____。

(5)SCOD是指溶解性化学需氧量,是衡量水中有机物质含量多少的指标。水体SCOD越大,说明其有机物含量越高。用Fe2+H2O2法氧化破解啤酒工业污泥中的微生物,释放出有机物和氮等。测得不同初始pH下污泥经氧化破解后上层清液中的SCOD及总氮浓度如上图所示。当pH>2.5时,总氮浓度、SCOD均降低,其原因可能是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com