
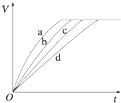
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得如图,则曲线a、b、c、d所对应的实验组别可能是( )| 组别 | c(HCl)/mol?L-1 | 温度(℃) | 状态 |
| 1 | 2.0 | 25 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.5 | 50 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A、①③ | B、②④ | C、①④ | D、②③ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
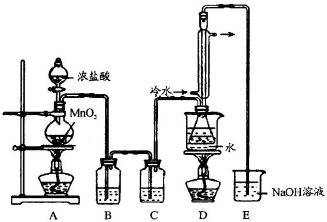 是工业上常用的硫化剂,实验室制备的方法有2种:
是工业上常用的硫化剂,实验室制备的方法有2种:| 111-140℃ |
| 95-100℃ |
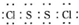 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如下:| 物质 | S | SC2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1.2g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
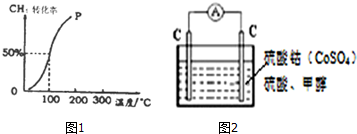
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com