
【题目】下图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列说法不正确的是( )
![]()
A. Y的氢化物比X的氢化物更稳定
B. 原子半径大小顺序是Z>Y>X>R
C. Z的单质能与Y的某些化合物发生置换反应
D. X、Y、Z三种元素中,其最高价氧化物对应水化物的酸性强弱顺序是Z>Y>X
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬。回答下列问题:
I.焦炭冶炼法。反应的化学方程式为FeCr2O4+4C![]() Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Ⅱ.铝热冶炼法。冶炼流程如下:

已知:4FeCr2O4+8Na2CO3 +7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①所得浸出液中的阴离子除CrO42-、CO32-、OH-外,还有____(忽略水解,填化学式)。
(2)步骤③需将pH调____(填“大”或“小”)。
(3)步骤④反应的离子方程式为____。若加H2SO4前c(CrO42-) =0. 020 mol/L,将溶液pH调至3时CrO42-浓度降为1.0×10-5 mol/L(加入H2SO4引起的体积变化可忽略),则该反应的平衡常数为____
(4)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的 Na2Cr2O7·2H2O晶体,其操作方法是____。

(5)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,该反应中氧化剂与还原剂的物质的量之比为 ___。可改用Na2 CrO4和Na2S反应得到Cr(OH)3,再热分 解得到Cr2O3。请配平下列化学方程式:___Na2CrO4+___Na2S+___H2O =___Cr(OH)3+___Na2 S2O3+___NaOH___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:
pC(g)+qD(g)(m、n、p、q均为化学计量数),根据图示曲线回答:

(1)正反应是___热反应。
(2)m+n___p+q(填“>”“<”或“=”)。
(3)若将纵坐标A的转化率换成A在平衡混合物中的质量分数,则逆反应是____ 热反应,m+n___p+q(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有A,B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。
(1)用电子式表示A与B两种元素构成的两种化合物分别为__________________和__________________,前者只有__________键;后者既有________键,又有________键。
(2)A的氢化物的电子式为_______,其中含有________键,它与水反应的化学方程式为____________。
(3)元素B的气态氢化物的电子式为___________________________________________,该分子中的键属于________(填“极性”或“非极性”)键,该氢化物与H+形成的键属于________。
(4)元素A的最高价氧化物的水化物的电子式为____________,其中既有________键,又有________键。
(5)B元素的单质有__________和__________,二者互称为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠中混有硫酸镁、硫酸钙、氯化镁杂质,除去杂质,加入的试剂顺序为( )
①![]() 、NaOH、
、NaOH、![]() 、HCl ②
、HCl ②![]() 、HCl、
、HCl、![]() 、NaOH
、NaOH
③NaOH、![]() 、
、![]() 、HCl ④
、HCl ④![]() 、
、![]() 、NaOH、HCl
、NaOH、HCl
A.①③B.①④C.②④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式_______________________________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1= +48 kJ·mol1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2= 30 kJ·mol1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
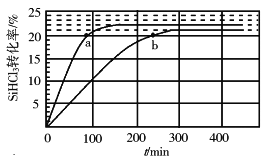
①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com