
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
【答案】B
【解析】A,NaHB溶液的pH=8.3说明HB-的水解程度(HB-+H2O![]() H2B+OH-)大于HB-的电离程度(HB-
H2B+OH-)大于HB-的电离程度(HB-![]() H++B2-),溶液中粒子浓度由大到小的顺序为:c(Na+)
H++B2-),溶液中粒子浓度由大到小的顺序为:c(Na+)![]() c(HB-)
c(HB-)![]() c(H2B)
c(H2B)![]() c(B2-),A项正确;B,等物质的量浓度的Na2S和NaHS溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),由于溶液呈碱性,c(OH-)
c(B2-),A项正确;B,等物质的量浓度的Na2S和NaHS溶液中的电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),由于溶液呈碱性,c(OH-)![]() c(H+),则c(Na+)
c(H+),则c(Na+)![]() c(HS-)+2c(S2-),B项错误;C,若NH4HSO4与NaOH以1:1物质的量之比混合,发生的反应为2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,所得溶液呈酸性,若NH4HSO4与NaOH以1:2物质的量之比混合,发生的反应为NH4HSO4+2NaOH=Na2SO4+NH3·H2O+H2O,所得溶液呈碱性,NH4HSO4溶液中滴加NaOH至溶液呈中性,则1:2
c(HS-)+2c(S2-),B项错误;C,若NH4HSO4与NaOH以1:1物质的量之比混合,发生的反应为2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O,所得溶液呈酸性,若NH4HSO4与NaOH以1:2物质的量之比混合,发生的反应为NH4HSO4+2NaOH=Na2SO4+NH3·H2O+H2O,所得溶液呈碱性,NH4HSO4溶液中滴加NaOH至溶液呈中性,则1:2![]() n(NH4HSO4):n(NaOH)
n(NH4HSO4):n(NaOH)![]() 1:1,溶液由Na2SO4、(NH4)2SO4和NH3·H2O混合而成,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(SO42-),溶液中粒子浓度由大到小的顺序为:c(Na+)
1:1,溶液由Na2SO4、(NH4)2SO4和NH3·H2O混合而成,溶液中的物料守恒为c(NH4+)+c(NH3·H2O)=c(SO42-),溶液中粒子浓度由大到小的顺序为:c(Na+)![]() c(SO42-)
c(SO42-)![]() c(NH4+)
c(NH4+)![]() c(OH-)=c(H+),C项正确;D,H2PO4-在溶液中既存在电离平衡(H2PO4-
c(OH-)=c(H+),C项正确;D,H2PO4-在溶液中既存在电离平衡(H2PO4-![]() H++HPO42-、HPO42-
H++HPO42-、HPO42-![]() H++PO43-)又存在水解平衡(H2PO4-+H2O
H++PO43-)又存在水解平衡(H2PO4-+H2O![]() H3PO4+OH-),0.1mol/LNaH2PO4溶液中的物料守恒为:c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4),D项正确;答案选B。
H3PO4+OH-),0.1mol/LNaH2PO4溶液中的物料守恒为:c(Na+)=c(H2PO4-)+c(HPO42-)+c(PO43-)+c(H3PO4),D项正确;答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是硫酸试剂瓶标签上的内容:
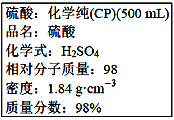
(1)该硫酸的物质的量浓度是____________________ molL-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL4.6 molL-1的稀硫酸,则需要取________mL的该硫酸来进行配制实验。
(3)将上述硫酸进行稀释的实验操作为________________________。
(4)用上述硫酸配制240mL4.6 molL-1的稀硫酸,实验仪器有:①50mL量筒 ②100mL量筒 ③托盘天平 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦烧杯 ⑧锥形瓶,实验时使用选用仪器的先后顺序为__________。
(5)下列操作会使配制的溶液浓度偏高的是_________________(填下列选项的编号字母)。
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.摇匀后,液面下降,补充水 D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙酸的下列叙述中错误的是( )
A.乙酸是有刺激性气味的液体,是食醋的主要成分
B.乙酸具有酸的通性,可以使石蕊等指示剂变色
C.乙酸在常温下可以发生酯化反应
D.乙酸可以和NaHCO3溶液反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的量的计算是中学化学的重要部分,请回答下列有关物质的量的计算问题。
(1)在标准状况下,67.2 L CO2是__________mol,质量为_______g,含有__________个CO2分子,其中含有__________mol氧原子。
(2)在标准状况下,1.7 g氨气所占的体积约为_________L,它与同条件下_____mol H2S含有相同的氢原子数。
(3)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(4)实验室常用浓硫酸的质量分数为98%,密度为1.80 g·mL1,其物质的量浓度是_______。
(5)标准状况下,将V L A气体(摩尔质量为M g/mol)完全溶于0.1 L水(密度1 g/cm3)中,所得溶液的密度为d g/mL,则此溶液的物质的量浓度为_______mol/L。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有HCl气体,另—个盛有H2和Cl2的混合气体。在同温同压下, 两容器内的气体一定具有相同的( )
A. 原子数 B. 密度 C. 质量 D. 质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机化合物A 6.8g,完全燃烧后生成3.6g水和8.96LCO2 (标准状况),已知该有机物的蒸汽对氢气的相对密度为68,则该有机物的分子式为________________ 。
(2)该有机物A的核磁共振氢谱和红外光谱如下:
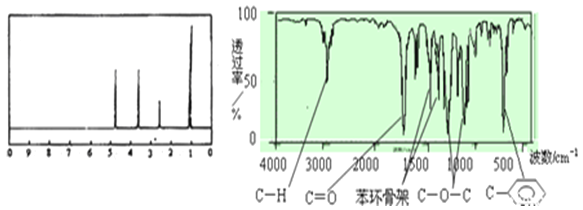
试推测有机物A的结构简式为____________________________ 。
(3)与A属于同类有机物的同分异构体共_____ 种,其结构简式分别为(不一定填满空格)
①________________ ② ③
④ ⑤ ⑥ ……
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
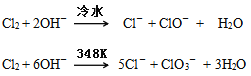
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:

装置中盛装的药品如下:①多用滴管中装有5mL浓盐酸;②微型支管试管中装有1.5gKMnO4;③微型支管试管中装有2~3mL浓硫酸;④U形反应管中装有30%KOH溶液;⑤U形反应管中装有2mol/LNaOH溶液;⑥、⑦双U形反应管中分别装有0.1mol/LKI-淀粉溶液和KBr溶液;⑧尾气出口用浸有0.5mol/LNa2S2O3溶液的棉花轻轻覆盖住

(1)整套装置气密性检查的方法_________________________。
(2)为了使装置④、⑤中的反应顺利完成,应该控制的反应条件分别为________________________________。
(3)装置⑥、⑦中能够观察到的实验现象分别是____________________。
(4)如果把装置⑥、⑦中的试剂互换位置,还能否证明氧化性:Cl2>I2,______(填“能”或“不能”),理由是:______________。
(5)已知氯酸钾和氯化钾的溶解度曲线如下图所示,反应结束后,从装置④中提取氯酸钾晶体的实验操作是_____________。
(6)尾气处理时发生反应的离子方程式为____________________。
(7)选择微型实验装置的优点有___________________(至少写两点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
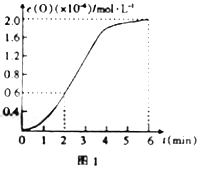
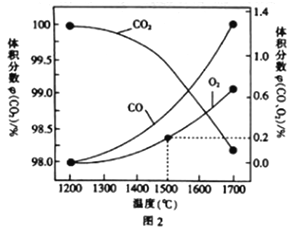
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
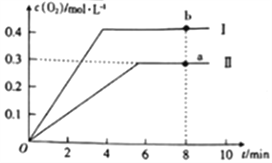
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com