
为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油。乙醇在气缸中完全燃烧的热化学方程式为:
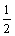 C2H5OH(l)+
C2H5OH(l)+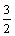 O2(g)=CO2(g)+
O2(g)=CO2(g)+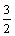 H2O(l) △H1=-683.4 kJ/mol
H2O(l) △H1=-683.4 kJ/mol
下列说法正确的是
A.该反应过程中,断裂化学键会放出热量
B.该反应中,生成物的总能量大于反应物的总能量
C.乙醇的燃烧热为683.4 kJ/mol
D.反应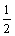 C2H5OH(l)+
C2H5OH(l)+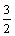 O2(g)=CO2(g)+
O2(g)=CO2(g)+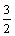 H2O(g)的△H2>-683.4 kJ/mol
H2O(g)的△H2>-683.4 kJ/mol
科目:高中化学 来源: 题型:
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)( )
|
| A. | BaCl2 | B. | NaOH | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是
A.在炭粉燃烧中加入KClO3
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在K2S04与BaCl2两溶液反应时,增大压强
D.Na与乙醇反应时增大乙醇的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特利原理来解释的是:
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温(合成氨反应为放热反应)
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3SCN -  Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+ 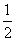 O2(g)
O2(g)  SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
SO3(g)。达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为
A.等于0.3mol B.等于0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
在-50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)  NH
NH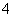 +NH
+NH ,
,
NH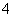 的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
的平衡浓度为1×10-15 mol·L-1,下列说法错误的是
A.在液氨中加入NaNH2,可使液氨的离子积变大
B.在液氨中加入NH4Cl,液氨的离子积不变
C.此温度下液氨的离子积K为1×10-30
D.在液氨中加入金属钠可能有NaNH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
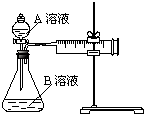 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
 ⑴写出草酸溶于水的电离方程式: 。
⑴写出草酸溶于水的电离方程式: 。
⑵该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=)。
⑶若实验①在2 min末收集了4.48 mL CO2(标准状况下),则
在2 min末, c(MnO4-)= mol/L。
⑷除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
⑸小组同学发现反应速率随时间变化如上图所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热,② 。
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式:RO3n—+F2+2OH-==RO4—+2F—+H2O,由此可知在RO3n—中,元素R的化合价是
A.+4 B.+5 C.+6 D.+7
查看答案和解析>>
科目:高中化学 来源: 题型:
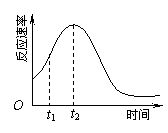
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
 |
现称取研细的黄铜矿样品1.840g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的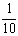 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00ml。请回答下列问题:
(1)称量样品所用的仪器为_____(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是_______ 。
(2)装置a和c的作用分别是____和____(填标号)。
a.除去SO2气体 b.除去空气中的水蒸气 c.有利于气体混合
d.有利于观察空气流速 e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____(填序号)。
 |
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com