
下列事实不能用勒夏特利原理来解释的是:
A.用排饱和食盐水的方法收集氯气
B.合成氨工业选择高温(合成氨反应为放热反应)
C.增大压强,有利于SO2和O2反应生成SO3
D.在Fe3++3SCN -  Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
某原电池构造如下图所示。其电池的
总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是
___________________________。
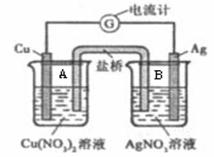 |
OH-离子移向_______(填“A”或“B”)中的溶液。Cu为原电池的______极,其电极反应式是_____________________________。A中的电解质溶液在该电池工作一段时间后会出现_______________________的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
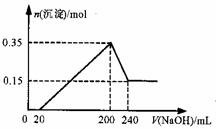 将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固 体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固 体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
A.Mg和Al的总质量为8g
|
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池总反应的离子方程式为2Fe3++Fe=3Fe2+,能实现该反应的原电池组成是( )
A.正极为铁,负极为铜,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学课外小组用右图装置制取溴苯并探
究该反应的类型。先向分液漏斗中加入苯和液溴,
再将混合液滴入反应器A(A下端活塞关闭)中。
(1)写出A中反应的化学方程式:_____________
_________________________________。
(2)实验结束时,打开A下端的活塞,让反应
液流入B中,充分振荡,目的是________
___________________________________。
(3)C中盛放CCl4的作用是_______________
__________________________________。
(4)若要证明苯和液溴发生的是取代反应,而不
是加成反应,通常有两种方法,请按要求填
写下表。
| 向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
| 方法一 | ||
| 方法二 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g) 2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) △H<0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
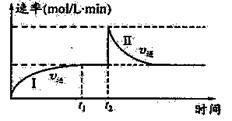
A. 0~t2时,v(正)>v(逆)
B. t2时刻改变的条件可能是加催化剂
C.Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ
D.Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
为解决能源危机,在汽油中掺入一定比例的乙醇(即“乙醇汽油”),以代替一部分汽油。乙醇在气缸中完全燃烧的热化学方程式为:
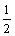 C2H5OH(l)+
C2H5OH(l)+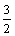 O2(g)=CO2(g)+
O2(g)=CO2(g)+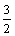 H2O(l) △H1=-683.4 kJ/mol
H2O(l) △H1=-683.4 kJ/mol
下列说法正确的是
A.该反应过程中,断裂化学键会放出热量
B.该反应中,生成物的总能量大于反应物的总能量
C.乙醇的燃烧热为683.4 kJ/mol
D.反应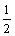 C2H5OH(l)+
C2H5OH(l)+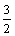 O2(g)=CO2(g)+
O2(g)=CO2(g)+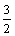 H2O(g)的△H2>-683.4 kJ/mol
H2O(g)的△H2>-683.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0 mol/L Na2SO4溶液,正确的方法是( )
① 将14.2 g Na2SO4 溶于100mL水中;② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 mL;③ 将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、SO42-、CO32-。将该混合物溶于水后得澄清溶液.现取3份l00mL该溶液分别进行如下实验:
| 试验序号 | 试验内容 | 试验结果 |
| 1 | 加AgNO3溶液 | 有白色沉淀生成 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体 1.12L(已折算成标准状况下的体积)[][] |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为 6.27g,第二次称量读数为 2.33g |
试回答下列问题:
(1)根据实验1对Cl-是否存在的判断是 (填“一定存在”、“一定不存在”或“不能确定”);根据实验l~3判断混合物中一定不存在的离子是 。
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mo1·L-) |
(3)试确定K+是否存在? ,判断的理由
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com