
【题目】已知硝酸与金属反应时,在不同条件下有不同的还原产物,甚至在同一反应中可同时得到多种还原产物。现有HNO3、NH4NO3、N2O、H2O、Zn、Zn(NO3)2六种物质。
(1)请利用其中五种物质组成一个完整的化学反应,写出该化学反应方程式:
________________________________________________________________;
(2)上述所写反应中,硝酸表现出的化学性质是_____,被还原的元素是_______。
(3)若六种物质组成一个完整的化学反应,则反应中的还原产物是______(填化学式),若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为____________。
(4)若六种物质组成一个完整的化学反应,且没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组。原因是____________________。
【答案】4Zn+10 HNO3=4Zn(NO3)2+NH4NO3+3H2O或4Zn+10 HNO3=4Zn(NO3)2+ N2O +5H2O 酸性与氧化性 +5价的N(或N) NH4NO3与N2O 3︰8 该反应中含两种还原产物,两者的比例不同,可导致氧化剂与还原剂的用量发生变化
【解析】
(1)金属锌具有还原性,发生氧化反应,Zn→Zn(NO3)2,化合价变化了2价,HNO3→0.5N2O,化合价变化了4价,生成1mol N2O,变化了8价,根据氧化还原反应化合价升降总数相等规律:Zn和Zn(NO3)2填系数4,N2O填系数1,根据氮原子守恒,HNO3的系数=4×2+2=10,其他系数根据原子守恒进行填写,该化学反应方程式:4Zn+10 HNO3=4Zn(NO3)2+ N2O +5H2O;
金属锌具有还原性,发生氧化反应,Zn→Zn(NO3)2,化合价变化了2价,HNO3→NH4NO3,化合价变化了8价,根据氧化还原反应化合价升降总数相等规律:Zn和Zn(NO3)2填系数4,NH4NO3填系数1,根据氮原子守恒,HNO3的系数=4×2+2=10,其他系数根据原子守恒进行填写,该化学反应方程式:4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;
故答案是:4Zn+10HNO3=4Zn(NO3)2+N2O +5H2O或4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O;
(2)上述所写反应中,硝酸中的氮元素化合价部分降低(+5价的氮元素被还原),部分未变价,形成硝酸盐,表现硝酸的酸性和氧化性;
故答案是:酸性与氧化性;+5价的N(或N);
(3)根据(1)分析可知,若六种物质组成一个完整的化学反应,则反应中的还原产物可以是NH4NO3或N2O;假设加入锌为1mol,NH4NO3与N2O物质的量均为xmol,根据电子守恒可知:1×2=x×[5-(-3)]+x×2×(5-1),x=![]() ;所以被还的硝酸n(HNO3)=2×
;所以被还的硝酸n(HNO3)=2×![]() +1×
+1×![]() =
=![]() ,若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为:
,若该反应中NH4NO3与N2O物质的量之比为1︰1,那么该反应中氧化剂与还原剂的物质的量之比为:![]() :1=3︰8;
:1=3︰8;
故答案是:NH4NO3或N2O;3︰8;
(4)若六种物质组成一个完整的化学反应,该反应中含两种还原产物,两者的比例不同,可导致氧化剂与还原剂的用量发生变化,则方程式可能的配平系数有许多组;
故答案是:该反应中含两种还原产物,两者的比例不同,可导致氧化剂与还原剂的用量发生变化。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在丙酮-盐酸混合溶液中,Fe3+比Cu2+的溶解度更大,用该溶液作展开剂分离Fe3+ 和Cu2+的装置如右图。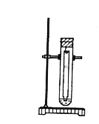
以下叙述错误的是
A.该方法为径向纸上层析法B.试样点晾干后才能补滴
C.试样点不能接触展开剂D.可喷KSCN溶液检验分离出来的Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
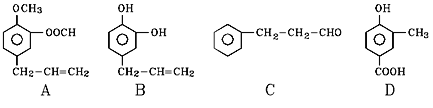
请回答下列问题:
(1)写出B中官能团的名称___________________;1mol B能与含____molBr2的溴水反应。
(2)既能使FeCl3溶液显紫色又能和NaHCO3溶液反应放出气体的是_________(用A、B、C、D填空)。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于______反应(填反应类型名称);酯F分子中共有11个碳原子,写出反应②的化学方程式____________________________。
![]()
(4)同时符合下列两项要求的D的同分异构体有4种:
①都是苯的1,2—二取代物;
②两个取代基分别为-OH和含有-COO-结构的基团
其中两种(G和H)结构简式如图所示,请补充另外两种。
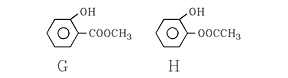
_______________________、_______________________________。
(5)写出H与足量NaOH溶液共热反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设空气中N2、O2的体积分数分别为0.8和0.2。在沸腾炉中将硫铁矿用空气中充分煅烧: 4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(1)所得气体中SO2的体积分数不超过_______%(保留一位小数)。
(2)若从接触室出来的气体中SO2、O2、N2、SO3的体积比为0.5:1:20:x,则x=_______,此时反应中SO2的转化率为_______%(保留一位小数)。
(3)在实际生产中,在接触室SO2与O2的体积比以1︰4较为适宜。若沸腾炉通入接触室的炉气中SO2、O2、N2的体积比为8:1:48,其流速为2.5m3/s, 则再往接触室里通入的空气的流速应为_______m3/s(保留一位小数;气体体积在同温同压下测定)。
(4)从吸收塔出来的气体用一定量氨水吸收,得到的铵盐产品是(NH4)2SO3和NH4HSO3的混合物。取不同质量的铵盐,分别加入x mol/L的50.00mL NaOH溶液中,经沸水浴(此温度下铵盐自身不分解)加热使氨气全部逸出,干燥后用浓硫酸完全吸收。实验数据如下:
实验次数 | 铵盐质量(g) | 浓硫酸增加的质量(g) |
第一次 | 1.570 | 0.340 |
第二次 | 3.140 | 0.680 |
第三次 | 4.710 | 0.510 |
第四次 | 6.280 | 0 |
①该铵盐中(NH4)2SO3和NH4HSO3的物质的量之比为___________。
②试求x的值:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以肼(N2H4)为燃料的新型环保电池的工作原理如图所示。下列说法正确的是
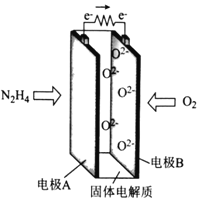
A. 电极A的电势比电极B的低
B. 电极A的电极反应式为N2H4-4e-+4OH-===N2+4H2O
C. 电极B发生氧化反应
D. 每消耗11.2L的O2,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.电解饱和食盐水时,若生成11.2LCl2,则生成H2分子的数目为0.5NA
B.28g分子式为CnH2n的链烃中含有的共用电子对数目为6NA
C.1mol晶体硅中含有的共价键数目为4NA
D.87gMnO2与100mL12mol·L-1的浓盐酸共热,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s) + 4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80℃达到平衡时,测得![]() ,则Ni(CO)4的平衡浓度为2mol/L
,则Ni(CO)4的平衡浓度为2mol/L
D.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时反应向正向进行。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com