
| A、Na+、NH4+、Cl-、CH3COO- |
| B、K+、Fe2+、SO42-、NO3- |
| C、Na+、K+、CO32-、ClO- |
| D、Al3+、Cu2+、SO42-、HS- |


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
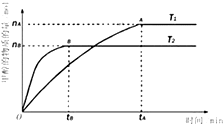 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.| nA |
| tA |
| n(H2) |
| n(CH3OH ) |
查看答案和解析>>
科目:高中化学 来源: 题型:
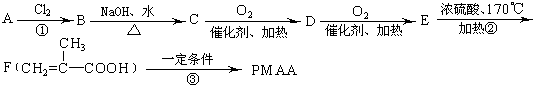
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红的溶液中:Ag(NH3)2+、H+、Na+、NO3- |
| B、0.1 mol?L-1 Fe3+溶液中:Cl-、SO42-、K+、C6H5OH |
| C、“84”消毒液的水溶液中:K+、Cl-、Na+、OH- |
| D、通入过量SO2气体的溶液中:K+、NO3-、Ba2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 mol?L-1?s-1 |
| B、t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度 |
| C、B的起始物质的量为0.02 mol |
| D、该化学反应的表达式为:3A(g)?B(g)+2C(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com