
����Ŀ��(1)3.01��1024��OH�����ʵ���Ϊ________mol�����е��ӵ���ĿΪ________����ЩOH��________gNa+���еĵ�������ͬ��
(2)��״���£�1.92gij��������Ϊ672mL����������Ħ������Ϊ______��
(3)ʵ����Ϊȷ��һƿϡ�����Ũ�ȣ���0.1000mol/LNaOH��Һ�к�25.00mL�����ᣬ�������ǡ����ȫ��Ӧʱ������NaOH��Һ24.50mL������������ʵ���Ũ��Ϊ______��
(4)ʵ���ҿ����ø�����غ�Ũ���ᷴӦ�Ʊ�������2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O����˫���ű������ת�Ƶķ������Ŀ___________���÷�Ӧ�б�������Ԫ����________���μӷ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ________������÷�Ӧ������ת����5mol���ӣ����ɵ������ڱ�״�������Ϊ__________L����������ȫ���ݳ�����
���𰸡�5 50NA 115g 64g/mol 0.0980mol/L  Cl 1:5 56L
Cl 1:5 56L
��������
(1)3.01��1024��OH�����ʵ���Ϊ![]() ��һ��OH-��������Ϊ10����3.01��1024��OH�����ӵ���ĿΪ50NA��һ��Na+��������Ϊ10������5molNa+��������Ϊ50NA������Ϊm=Mn=5mol��23g/mol=115g��
��һ��OH-��������Ϊ10����3.01��1024��OH�����ӵ���ĿΪ50NA��һ��Na+��������Ϊ10������5molNa+��������Ϊ50NA������Ϊm=Mn=5mol��23g/mol=115g��
(2)��״���£�1.92gij��������Ϊ672mL���������ʵ���Ϊ![]() ������Ħ������Ϊ
������Ħ������Ϊ![]() ��
��
(3)NaOH��Һ�����ᷴӦʱ����ʽΪNaOH+HCl=NaCl+H2O��NaOHŨ��Ϊ0.1000mol/L�����ĵ����Ϊ24.50mL�����ݷ���ʽ��֪�����Ũ��ӦΪ![]() ��
��
(4)��Ӧ�У�MnԪ�صĻ��ϼ���+7����Ϊ+2���õ��ĵ���Ϊ2��(7-2)e-=10e-��ClԪ�صĻ��ϼ���-1����Ϊ0��ʧȥ�ĵ���Ϊ5��2��(1-0)e-=10e-��˫���ű����Ӧ�е��ӵ�ת�Ʒ������ĿΪ ����Ӧ��ClԪ�ػ��ϼ����߱���������Ӧ��KMnO4��MnԪ�ػ��ϼ۽�����������������HCl��ClԪ�ػ��ϼ���������ԭ��������˫���ſ�֪�������ͻ�ԭ�����ʵ���֮��Ϊ2:10����1:5������˫���ſ�֪ת��5mol����ʱ���ɵ�Cl2�����ʵ���Ϊ2.5mol����״�������Ϊ2.5mol��22.4L/mol=56L��
����Ӧ��ClԪ�ػ��ϼ����߱���������Ӧ��KMnO4��MnԪ�ػ��ϼ۽�����������������HCl��ClԪ�ػ��ϼ���������ԭ��������˫���ſ�֪�������ͻ�ԭ�����ʵ���֮��Ϊ2:10����1:5������˫���ſ�֪ת��5mol����ʱ���ɵ�Cl2�����ʵ���Ϊ2.5mol����״�������Ϊ2.5mol��22.4L/mol=56L��


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��F��G��H����Ԫ�أ���Ϊǰ������Ԫ�أ����ǵ�ԭ����������������������������Ϣ���ش��й����⡣
AԪ�صĺ���������͵��Ӳ�����ȣ�Ҳ����������ḻ��Ԫ�� |
BԪ�����γɻ�������������Ԫ�� |
CԪ�ػ�̬ԭ�ӵĺ���p��������s��������1 |
DԪ�ػ�̬ԭ�ӵĺ���p�����������δ�ɶԵ��� |
EԪ�ص���̬��̬ԭ�ӵĵ�һ�����ĵ����ֱܷ��ǣ� I1=738kJ/mol��I2 = 1451 kJ/mol��I3 = 7733kJ/mol��I4 = 10540kJ/mol |
FԪ�ص������������������IJ�Ϊ4 |
GԪ����ǰ�������е縺����С��Ԫ�� |
HԪ��λ��Ԫ�����ڱ��еĵڰ��� |
��1��C2A4�ĵ���ʽΪ______________����A��CΪ��ĸ���ţ��뽫��ĸ������Ԫ�ط��ű�ʾ����ͬ��
��2��BԪ�ص�ԭ�Ӻ����______�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬ԭ����������ߵĵ�����ռ�ݵ�ԭ�ӹ����_______����
��3��ijͬѧ�ƶ�EԪ�ػ�̬ԭ�ӵĺ�������Ų�ͼΪ��![]() ����ͬѧ�����ĵ����Ų�ͼΥ����________________����Ԫ�ص�ԭ��I3ԶԶ����I2����ԭ����__________________________________��
����ͬѧ�����ĵ����Ų�ͼΥ����________________����Ԫ�ص�ԭ��I3ԶԶ����I2����ԭ����__________________________________��
��4��D��E��F����Ԫ�صļ����Ӱ뾶�ɴ�С��˳����_______________���������ӷ��ű�ʾ��
��5���ö��Ե缫���EF2��ˮ��Һ�����ӷ���ʽΪ_____________________________��
��6��Hλ��Ԫ�����ڱ���_______�����������Ų������������̬ԭ�ӵļ۵����Ų�ʽΪ_________��ʵ������һ�ֻ�ɫ��Һ����H2+ʱ������ɫ�������÷�Ӧ�����ӷ���ʽΪ__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����27.2gCu��Cu2O�Ļ�����м���ijŨ�ȵ�ϡ����0.5L������������ȫ��Ӧ������NO��Cu(NO3)2����������Һ�м���1.0mol/L��NaOH��Һ1.0L����ʱ��Һ�����ԡ�������������ȫ��������������Ϊ39.2g�������й�˵������ȷ����
A. Cu��Cu2O�����ʵ���֮��Ϊ2��1 B. ��������ʵ���Ũ��Ϊ2.6mol/L
C. ������NO�ڱ�״���µ����Ϊ4.48L D. Cu��Cu2O�����ᷴӦ��ʣ��HNO3Ϊ0.2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��W��X��Y��Z��ԭ�������������ӣ��Ҿ�С��20��W��X��Y��Z��������֮��Ϊ12��X��Y�ĵ��Ӳ�����ͬ���������ZWY��Һ�е�������������Һ���۲쵽���к�ɫ�����������г�������ζ������ų�������˵����ȷ���ǣ� ��
A. ZWY�����ӻ�����ȿ������ᷴӦ�ֿ�����Ӧ
B. ����X�۵�ߡ�Ӳ�ȴ�����������ά
C. ԭ�Ӱ뾶��С�����˳��Ϊ��![]()
D. ���ȶ��ԣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ѻ�(NH4)2SO4��NH4NO3�Ļ��ҺaL�ֳ����ȷݡ�һ�ݼ���bmolNaOH�����ȣ�ǡ�ð�NH3ȫ���ϳ�����һ��������cmolBaCl2������Ӧǡ����ȫ����ԭ��Һ��NO3-��Ũ��Ϊ����
A.![]() mol/LB.
mol/LB.![]() mol/LC.
mol/LC.![]() mol/LD.
mol/LD.![]() mol/L
mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ��Я�ַ�����ȫ����ϩ�Ŵ�һB40��B40�ŴصĽṹ�������й��ĺ��������ͼ)�ò��Ͽ�������װ�����������ڴ��ⴢﮡ��뵼�塢��������ɫ�������������ҪӦ��ǰ��,�����й�˵����ȷ����
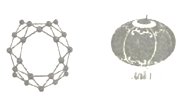
A.��ʯīϩ�Ľṹ��ͬ������Ϊͬ��������
B.44.0g�����ʺ���2.408��1024��ԭ��
C.B40�мȺ����Լ����ֺ��зǼ��Լ�
D.ȫ����ϩ�Ŵ���һ�����͵ĸ߷��Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� N2��g����H2��g�������������澭�����¹�������NH3��g����������˵����ȷ����

A.�����ƻ��ľ�Ϊ���Լ�
B.����NH2��H2����NH3
C.������������Ϊ���ȹ���
D.N2��g��+3H2��g��![]() 2NH3��g��1mol������ȫ��Ӧ����44kJ
2NH3��g��1mol������ȫ��Ӧ����44kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����������װ�ã�������������ص�ʵ�顣
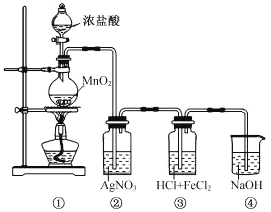
(1)װ�â���NaOH��Һ��������___________��
(2)ʵ�������ȡװ�â��е���Һ��������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����õ�FeCl3��6H2O���塣������Ũ�������У�����Ҫ��������___________��
A�������� B��©�� C�������� D���ƾ���
(3)װ�â��г��ְ�ɫ�������ݴ������ܷ��Ʋ�װ�â�������Cl2___________________����˵������_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ѧ�е�һЩ������������ͼת����ϵ������A��HΪ�����е���Ҫ�ɷ֣�����B��ʹʪ��ĺ�ɫʯ����ֽ����������D����A�ܿ��ɺ���ɫE��C���������I���Ϻ�ɫ�������ʡ�XΪ����Һ��(���ַ�Ӧ������������û��ȫ���г�)��

�ش��������⡣
(1)C�Ļ�ѧʽΪ________��
(2)X�ĵ���ʽΪ________��
(3)д����Ӧ�ٵĻ�ѧ����ʽ__________________________________________��
(4)д����Ӧ�ڵ����ӷ���ʽ__________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com