
【题目】近年来,我国北京等地出现严重雾霾天气,据研究,雾霾的形成与汽车排放的![]() 、
、![]() 等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为
等有毒气体有关,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体,反应方程式为![]() 。对于该反应,温度不同(
。对于该反应,温度不同(![]() )其他条件相同时,下列图像正确的是
)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
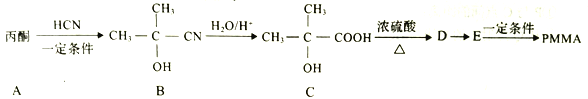
【题目】I.聚甲基丙烯酸甲酯(PMMA)俗称有机玻璃。其结构简式为: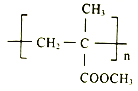 。以下是有机玻璃的一种合成路线:
。以下是有机玻璃的一种合成路线:
回答下列问题:
(1)A的结构简式为________,A生成B的反应类型是______反应。
(2)C中官能团的名称是________ ,D的名称是________(系统命名法)。
(3)由E生成PMMA的化学方程式为____________。
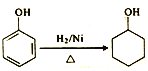
II.由合成PMMA得到的启示,可应用于由苯酚为主要原料制备![]()
(4)![]() 的同分异构体中符合下列条件的有_____种(不考虑立体异构):
的同分异构体中符合下列条件的有_____种(不考虑立体异构):
①属于![]() 的二取代物
的二取代物
②取代基处于对位且完全相同
③能够与NaHCO3溶液反应产生CO2
其中核磁共振氢谱有5个峰,峰面积之比为6:2:1:1的是_________(填结构简式)。
(5)参照I中有机玻璃的合成路线,设计并完善![]() 的合成路线:
的合成路线:
 ____________
____________![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中一定正确的是
A. 1molFe与高温水蒸气反应,转移电子的数目为3NA
B. 标准状况下,2.24LHF中含有的极性键数目为0.1NA
C. 5mL0.1mol/LCH3COOH溶液和10mL0.5mol/LCH3COOH溶液中所含CH3COOH分子数相等
D. 一定条件下,向0.1L容器内通入4.6gNO2气体,NO2的物质的量浓度小于1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,其基本合成过程如下:
2NH3(g) H<0合成氨,其基本合成过程如下:
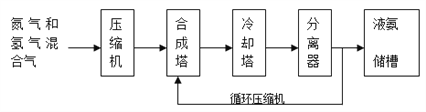
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(N2)=___________mol·L-1·min-1。
②相对a而言,b可能改变的条件是______________________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1~t2时刻c(H2)的变化曲线________。
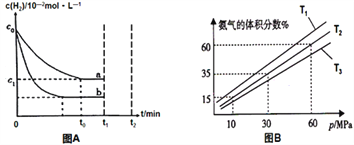
(2)某小组往一恒温恒压容器充入9 mol N2和23 mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
① 此时N2的平衡分压为__________MPa,H2的平衡分压为___________MPa。(分压=总压×物质的量分数)
② 列式计算此时的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
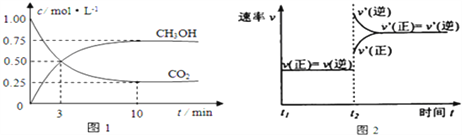
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= ______ 。图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 _____ 反应(填“放热”或“吸热”)。
(2)下列各项能作为判断该反应达到平衡标志的是____(填序号字母)。
A.容器内压强保持不变 B.v正(CO2)=3v逆(H2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(3)500℃该反应的平衡常数为 ______ (保留两位小数),若提高温度到 800℃进行,达平衡时,K值 ______ (填“增大”“减小”或“不变”).
(4)下列措施中不能使CO2的转化率增大的是 ______ 。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离
(5)500℃,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
(6)下列措施能使n(CH3OH)/n(CO2)增大的是 ______ 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知AB3易溶于有机溶剂,不溶于水,则下列说法正确的是( )
A. AB3是非极性分子 B. A原子p能级中无空轨道
C. A原子为sp3杂化 D. AB3为三角锥形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
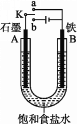
(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
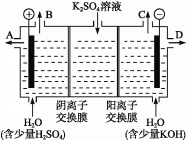
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧、得到CuO24.0g,若上述气体为NO和NO2的混合物,且体积比为1:2。则V可能为
A. 9.0 L B. 18.5L C. 25.7L D. 36.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能用H++OH﹣═H2O来表示的化学反应是( )
A.氢氧化镁和稀盐酸反应
B.Ba(OH)2溶液滴入稀硫酸中
C.二氧化碳通入澄清石灰水中
D.澄清石灰水和稀硝酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com