
����Ŀ����ҵ����CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飺���ݻ�Ϊ1L���ܱ������У�����1molCO2��3molH2����500���·�����Ӧ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯��ͼ1��ʾ��
CH3OH��g��+H2O��g��ʵ����CO2��CH3OH��g�������ʵ�����n����ʱ��仯��ͼ1��ʾ��
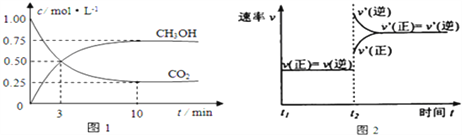
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��= ______ ��ͼ2�Ǹı��¶�ʱ��ѧ��Ӧ������ʱ��仯��ʾ��ͼ����÷�Ӧ������ӦΪ _____ ��Ӧ��������������������������
��2�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ���־����____(�������ĸ)��
A.������ѹǿ���ֲ��� B.v��(CO2)=3v��(H2)
C.������CO2������������� D.���������ܶȱ��ֲ���
��3��500��÷�Ӧ��ƽ�ⳣ��Ϊ ______ ��������λС������������¶ȵ� 800����У���ƽ��ʱ��Kֵ ______ ����������������С��������������.
��4�����д�ʩ�в���ʹCO2��ת����������� ______ ��
A����ԭ�������ٳ���1mol H2 B����ԭ�������ٳ���1molCO2
C����С�������ݻ� D��ʹ�ø���Ч�Ĵ��� E����ˮ��������ϵ�з���
��5��500�棬���ijʱ�̣�CO2��g����H2��g����CH3OH��g����H2O��g����Ũ�Ⱦ�Ϊ0.5mol/L�����ʱv������ ______ v���棩��������������������=������
��6�����д�ʩ��ʹn��CH3OH��/n��CO2��������� ______ ��
A�������¶� B����ԭ�����г���1molHe
C����ˮ��������ϵ�з���� D����С�����ݻ�������ѹǿ
���𰸡� 0.225mol/��Lmin�� ���� A C 5.33 ��С BD �� CD
��������������������⿼��ͼ��ķ�������ѧ��Ӧ���ʵļ��㣬��ѧƽ��ı�־����ѧƽ�ⳣ���ļ����Ӧ�ã���������Ի�ѧƽ���Ӱ�졣
��1����ͼ1��֪�ӿ�ʼ��ƽ��CO2���ʵ���Ũ����1.00mol/L��С��0.25mol/L������CO2��=��1.00mol/L-0.25mol/L��![]() 10min=0.075mol/(L��min)��������H2��=3����CO2��=3
10min=0.075mol/(L��min)��������H2��=3����CO2��=3![]() 0.075mol/(L��min)=0.225mol/(L��min)����ͼ2֪���ı��¶ȣ������淴Ӧ���ʶ��ӿ�˵��Ϊ�����¶ȣ��淴Ӧ���ʴ�������Ӧ���ʣ��������¶�ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����÷�Ӧ������ӦΪ���ȷ�Ӧ��
0.075mol/(L��min)=0.225mol/(L��min)����ͼ2֪���ı��¶ȣ������淴Ӧ���ʶ��ӿ�˵��Ϊ�����¶ȣ��淴Ӧ���ʴ�������Ӧ���ʣ��������¶�ƽ�����淴Ӧ�����ƶ����淴ӦΪ���ȷ�Ӧ����÷�Ӧ������ӦΪ���ȷ�Ӧ��
��2��A��÷�Ӧ������ӦΪ�����������С�ķ�Ӧ������ƽ��������������ʵ�����С��������ѹǿ��С��ƽ��ʱ�������ʵ������䣬������ѹǿ���䣬������ѹǿ���ֲ�����˵����Ӧ�ﵽƽ��״̬��B��������(CO2)=3����(H2)�����������淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬��C����������CO2������������������Ӧ�ﵽƽ��״̬��D������������ʼ�ղ��䣬������������䣬���������ܶ�ʼ�ղ��䣬���������ܶȱ��ֲ��䲻��˵����Ӧ�ﵽƽ��״̬����˵����Ӧ�ﵽƽ��״̬����A��C����ѡAC��
��3�����ͼ1��������ʽ
CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g��
CH3OH��g��+H2O��g��
c����ʼ����mol/L��1.00 3 0 0
c��ת������mol/L��0.75 2.25 0.75 0.75
c��ƽ�⣩��mol/L��0.25 0.75 0.75 0.75
500��÷�Ӧ��ƽ�ⳣ��Ϊ![]() =5.33���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����ѧƽ�ⳣ��Kֵ��С��
=5.33���÷�Ӧ������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�����淴Ӧ�����ƶ�����ѧƽ�ⳣ��Kֵ��С��
��4��A���ԭ�������ٳ���1mol H2��ƽ��������Ӧ�����ƶ���CO2��ת��������B���ԭ�������ٳ���1molCO2��ƽ��������Ӧ�����ƶ���������������ԭ�����ı�Ӱ��ƽ���һ��������ƽ�����ż������ָı�ķ����ƶ����������������ָı�����CO2��ת���ʼ�С��C������С�������ݻ���ƽ��������Ӧ�����ƶ���CO2��ת��������D����ʹ�ø���Ч�Ĵ�����ƽ�ⲻ�ƶ���CO2��ת���ʲ��䣻E������ˮ��������ϵ�з�����ƽ��������Ӧ�����ƶ���CO2��ת����������ʹCO2ת�����������B��D����ѡBD��
��5����ʱ�̵�Ũ����Ϊ![]() =4
=4![]() 5.33����Ӧ������У���������
5.33����Ӧ������У���������![]() �����棩��
�����棩��
��6��A������¶���ƽ�����淴Ӧ�����ƶ���n��CH3OH��/n��CO2����С��B���ԭ�����г���1molHe�����ڸ����ʵ�Ũ��û�иı䣬ƽ�ⲻ�����ƶ���n��CH3OH��/n��CO2��������C������ˮ��������ϵ�з��������С������Ũ�ȣ�ƽ��������Ӧ�����ƶ���n��CH3OH��/n��CO2������D������С�����ݻ�������ѹǿ��ƽ��������Ӧ�����ƶ���n��CH3OH��/n��CO2��������ʹn��CH3OH��/n��CO2���������C��D����ѡCD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С��̽����������Ի�ѧ��ӦmA(g)��nB(g) ![]() pC(g)�����ʺ�ƽ���Ӱ��ͼ�����£������ж���ȷ������ ��
pC(g)�����ʺ�ƽ���Ӱ��ͼ�����£������ж���ȷ������ ��

A. ��ͼ1��֪��T1��T2���÷�Ӧ����ӦΪ���ȷ�Ӧ
B. ��ͼ2��֪���÷�Ӧm��n��p
C. ͼ3�У���ʾ��Ӧ����v��>v�����ǵ�3
D. ͼ4�У���m��n��p����a����һ��ʹ���˴���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ĺ�������Ų�ʽΪ1s22s22p6�����й��ڸ�����˵��һ����ȷ����(����)
A. ������Ϊ10 B. ���ʾ��л�ԭ��
C. �ǵ�ԭ�ӷ��� D. ������Ϊ10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д����������
A. ʹ��̪���ɫ����Һ��:Na+��Cu2+��HCO3-��NO3-
B.  =1x10-13mol/L����Һ��:NH4+��Ca2+��Cl-��NO3-
=1x10-13mol/L����Һ��:NH4+��Ca2+��Cl-��NO3-
C. ��Al��Ӧ�ܷų�H2����Һ��:Fe3+��K+��NO3- ��SO42-
D. 0.1mol/LNaAlO2��Һ:H+��Na+��Cl-��SO42-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ������Һ�м������п��H2�ų������ڸ���Һ��һ���ܴ���������ǣ� ��
A.Cu2+ Cl�� K+ SO42��
B.Na+ NO3�� OH �� CO32��
C.Ba2+ Cl�� NO3�� SO42��
D.K+ Na+ Cl�� SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ҹ������ȵس��������������������о����������γ��������ŷŵ�![]() ��
��![]() ���ж������йأ���������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����壬��Ӧ����ʽΪ
���ж������йأ���������װβ������װ�ã���ʹ�ж��������Ӧת��Ϊ�����壬��Ӧ����ʽΪ![]() �����ڸ÷�Ӧ���¶Ȳ�ͬ��
�����ڸ÷�Ӧ���¶Ȳ�ͬ��![]() ������������ͬʱ������ͼ����ȷ����
������������ͬʱ������ͼ����ȷ����

A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() �DZ�
�DZ�![]() �������ᣬ��ˮ�д�������ƽ�⣺
�������ᣬ��ˮ�д�������ƽ�⣺![]() ��
��![]() ���ﵽƽ���Ҫʹ
���ﵽƽ���Ҫʹ![]() ��Ũ�����ɼ���������������������
��Ũ�����ɼ���������������������
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ij��Һ����ˮ���������C��H+����C��OH-���ij˻�Ϊ1��10-20������Һ��һ���ܴ������ڵ�������
A. CO32- B. HCO3- C. Ba2+ D. NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ���(����)
A. NaCl(aq)![]() NaHCO3(s)
NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)
B. FeS2![]() SO2
SO2![]() H2SO4
H2SO4
C. SiO2![]() SiCl4
SiCl4![]() Si
Si
D. N2![]() NH3
NH3![]() NH4Cl(aq)
NH4Cl(aq)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com