
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 使酚酞变红色的溶液中:Na+、Cu2+、HCO3-、NO3-
B.  =1x10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
=1x10-13mol/L的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 与Al反应能放出H2的溶液中:Fe3+、K+、NO3- 、SO42-
D. 0.1mol/LNaAlO2溶液:H+、Na+、Cl-、SO42-、
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCaCl2溶液中滴加0.mol/L的Na2CO3溶液,滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是

A. Ksp(CaCO3)=5×10-10
B. Z点对应的分散系很稳定
C. W、x、y三点中,水的电离程度最大的为y点
D. 若用等浓度的Na2SO4溶液代替Na2CO3溶液,则图像在x点后的变化如虚线部分所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. H2SO4的摩尔质量是98
B. 等质量的O2和O3中所含的氧原子数相同
C. 等质量的CO与CO2中所含碳原子数之比为7︰11
D. 98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中一定正确的是
A. 1molFe与高温水蒸气反应,转移电子的数目为3NA
B. 标准状况下,2.24LHF中含有的极性键数目为0.1NA
C. 5mL0.1mol/LCH3COOH溶液和10mL0.5mol/LCH3COOH溶液中所含CH3COOH分子数相等
D. 一定条件下,向0.1L容器内通入4.6gNO2气体,NO2的物质的量浓度小于1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”。下列做法不利于保护环境的是( )
A.推广使用电动汽车等低碳交通工具
B.推广垃圾分类,电子设备以旧换新
C.用生物方法脱除生活污水中的氮和磷
D.加大铅酸蓄电池、含汞锌锰等电池的生产
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气有广泛用途,工业上利用反应N2(g)+3H2(g) ![]() 2NH3(g) H<0合成氨,其基本合成过程如下:
2NH3(g) H<0合成氨,其基本合成过程如下:
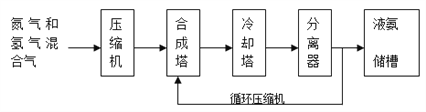
(1)某小组为了探究外界条件对反应的影响,以c0 mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A。
①a条件下,0~t0的平均反应速率v(N2)=___________mol·L-1·min-1。
②相对a而言,b可能改变的条件是______________________________。
③在a条件下t1时刻将容器体积压缩至原来的1/2,t2时刻重新建立平衡状态。请在答题卡相应位置画出t1~t2时刻c(H2)的变化曲线________。
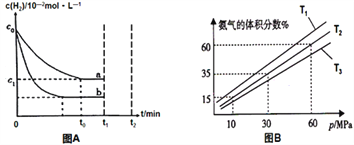
(2)某小组往一恒温恒压容器充入9 mol N2和23 mol H2模拟合成氨反应,图B为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。若体系在T2、60MPa下达到平衡。
① 此时N2的平衡分压为__________MPa,H2的平衡分压为___________MPa。(分压=总压×物质的量分数)
② 列式计算此时的平衡常数Kp=____。(用平衡分压代替平衡浓度计算,结果保留2位有效数字)
(3)分离器中的过程对整个工业合成氨的意义是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
CH3OH(g)+H2O(g)实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如图1所示:
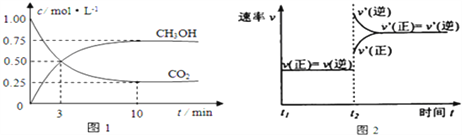
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= ______ 。图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为 _____ 反应(填“放热”或“吸热”)。
(2)下列各项能作为判断该反应达到平衡标志的是____(填序号字母)。
A.容器内压强保持不变 B.v正(CO2)=3v逆(H2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(3)500℃该反应的平衡常数为 ______ (保留两位小数),若提高温度到 800℃进行,达平衡时,K值 ______ (填“增大”“减小”或“不变”).
(4)下列措施中不能使CO2的转化率增大的是 ______ 。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离
(5)500℃,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0.5mol/L,则此时v(正) ______ v(逆)(填“>”“<”或“=”)。
(6)下列措施能使n(CH3OH)/n(CO2)增大的是 ______ 。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组用如图装置进行实验,试回答下列问题:
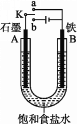
(1)若开始时开关K与a连接,则B极的电极反应为____________________。
(2)若开始时开关K与b连接,则B极的电极反应为____________________,总反应的离子方程式为____________________。
(3)有关上述实验,下列说法正确的是______。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
D.若标准状况下B极产生2.24 L气体,则溶液中转移0.2 mol电子
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
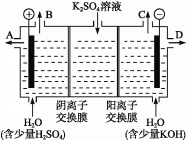
①该电解槽的阳极反应为______________。 此时通过阴离子交换膜的离子数_____(填“大于”“小于”或“等于”)通过阳离子交换膜的离子数。
②制得的氢氧化钾溶液从出口(填“A”、“B”、“C”或 “D”)________导出。
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃按沸点由高到低顺序排列正确的是( )
①正丁烷②异丁烷③正戊烷④异戊烷⑤新戊烷
A.①②③④⑤B.⑤④③②①C.③①⑤④②D.③④⑤①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com