
 短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族.
短周期元素A、B、X、Y、Z原子序数依次增大,A元素所处的周期数、主族序数、原子序数均相等,B的气态氢化物是天然气的主要成分,Y的最外层电子数是其内层电子数的3倍,Z单质可制成半导体材料,B、Z同主族. ,故答案为:
,故答案为: ;
;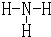 ,形成的铵根离子化学式为NH4+,
,形成的铵根离子化学式为NH4+,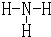 ;NH4+;
;NH4+;

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
 某有机物的结构如图所示,这种有机物不可能具有的性质是( )
某有机物的结构如图所示,这种有机物不可能具有的性质是( )| A、①④ | B、②⑤ | C、③⑥ | D、④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、OH-、NO3- |
| B、Na+、Fe3+、NO3-、Cl- |
| C、H+、Fe3+、HCO3-、SO42- |
| D、Ag+、Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com