
| ||
| A、①④表现出酸性 |
| B、①②表现出氧化性 |
| C、③既表现出氧化性又表现出酸性 |
| D、③④表现出还原性 |
| ||
| ||


科目:高中化学 来源: 题型:
| r+/r- | 配位数 | 实例 |
| 0.225~0.414 | 4 | ZnS |
| 0.414~0.732 | 6 | NaCl |
| 0.732~1.0 | 8 | CsCl |
| >1.0 | 12 | CsF |
| A、该晶体结构与ZnS晶体相似 | |||||
| B、该晶体每个晶胞中有2个A2+和B2- | |||||
C、该晶体晶胞的边长
| |||||
| D、A2+离子紧邻的B2-构成的空间结构为正方体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
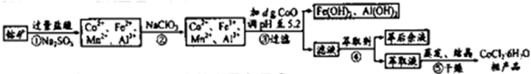
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇结构中有-OH,其水溶液可以电离出OH-而显碱性 |
| B、乙醇与乙酸在一定条件下反应生成乙酸乙酯 |
| C、乙醇与钠反应可以产生氢气,所以乙醇显酸性 |
| D、乙醇与钠反应比较平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液中滴加稀盐酸 |
| B、硫酸铁溶液中滴加硫氰化钾溶液 |
| C、碘水中滴加淀粉碘化钾溶液 |
| D、高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、H2O(g)═H2(g)+
| ||
| B、2H2(g)+O2(g)═2H2O(l)△H=-484 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com