
已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(1)a点溶液中c(H+)为 。
(2)b点溶液中离子浓度大小顺序为 或 或 。c点溶液中的离子浓度大小顺序为 。
(3)a、b、c三点中水的电离程度最大的是 ,滴定过程中宜选用 作指示剂。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
一定温度下,卤化银AgX(X:Cl—、Br—、I—)及Ag2CrO4的沉淀溶解平衡曲线如图所示。横坐标p(Ag+)表示“-lgc(Ag+)”,纵坐标Y表示“ -lgc(X-)”或“-lgc(CrO42—)”。下列说法正确的是
| A.a点表示c(Ag+)=c(CrO42—) |
| B.b点可表示AgI的饱和溶液 |
| C.该温度下AgI的Ksp约为1×10—16 |
| D.该温度下AgCl、AgBr饱和溶液中:c(Cl—)<c(Br—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 实验编号 | 起始浓度/mol·L-1 | 反应后溶液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
 mol·L-1
mol·L-1查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向100 mL 0.01 mol·L-1 HA溶液中逐滴加入0.02 mol·L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,正确的是( )
| A.HA可能为一元弱酸 |
| B.MOH为一元强碱 |
| C.N点水的电离程度小于K点水的电离程度 |
| D.若K点对应的溶液的pH=10,则有c(MOH)+c(M+)="0.01" mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表列出了几种常见物质的电离常数或溶度积:
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
| A.由水电离出的c(H+)=10-9 mol/L的HF溶液 |
| B.pH=10的氨水 |
| C.1 mol/L的NaHCO3溶液 |
| D.10-9 mol/L的AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
| A.升高温度,溶液的pH降低 |
| B.c(Na+)=2c(SO32―)+c(HSO3-)+c(H2SO3) |
| C.c(Na+)+c(H+)=2c(SO32―)+2c(HSO3-)+c(OH―) |
| D.加入少量NaOH固体,c(SO32―)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有pH=5的CH3COOH溶液10 mL,要使其pH增大3,可采取的方法有( )
| A.向溶液中加水稀释至10 L |
| B.加入一定量的NaOH固体 |
| C.加入一定量pH=8的NaOH溶液 |
| D.加入一定浓度的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中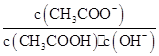 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图8-2(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )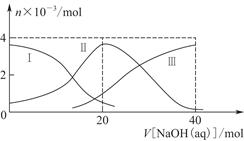
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com