
����Ŀ�������仯���������ǵ����������
(1)����β����NO���ɹ��̵������仯ʾ��ͼ���£�

�������£�1mol N2��1molO2��ȫ��Ӧ����NO����_______________(���������������ų���)________kJ������
(2)һ���¶��£������Ϊ0.5 L�ĺ����ܱ������У�������̬������X��Y֮�䷴Ӧ�����и����ʵ����ʵ�����ʱ��Ĺ�ϵ��ͼ��ʾ��
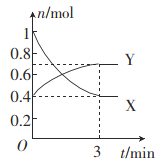
�ٸ÷�Ӧ�Ļ�ѧ��Ӧ����ʽ��______________________��
����0��3 min�ڣ���Y��ʾ�ķ�Ӧ����Ϊ____________��
������������˵���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����________(����ĸ)��
a��������ѹǿ���ٷ����仯
b��X������������ٷ����仯
c��������ԭ���������ٷ����仯
d����ͬʱ��������nmolY��ͬʱ����2nmol X
�ܷ�Ӧ�ﵽƽ����������¶ȣ�����(��)______����(��)________��(��������������С������������)��
(3)��Ӧ A(g)+3B(g)�T2C(g)+3D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ��
���� (A)=0.015mol (Ls)��1 ���� (B)=0.09mol (Ls)��1
���� (C)=2.4mol (Lmin )��1 ���� (D)=0.045mol (Ls)��1
�÷�Ӧ�����ֲ�ͬ����������ɴ�С��˳��Ϊ(��������)________��
���𰸡����� 183 2XY 0.2mol/(L��min) ab ��С ��С ��>��>��=��
��������
(1)���ϼ����յ����������ڳɼ��ų���������Ϊ���ȷ�Ӧ����֮Ϊ���ȷ�Ӧ��
(2) �ٷ�Ӧ������ʵ������٣�����������ʵ��������࣬�������ʵ����ı仯�жϼ�����֮��Ĺ�ϵ��
�ڸ���![]() ����������Y��ʾ��ƽ����Ӧ���ʣ�
����������Y��ʾ��ƽ����Ӧ���ʣ�
�۸���ƽ���־�ж��Ƿ�ﵽƽ��״̬��
�ܽ����¶ȷ�Ӧ����һ����С��
(3)���ݷ�Ӧ����֮�ȵ��ڻ�ѧ������֮���жϡ�
(1)����ͼʾ���ϼ����յ���������945 kJ +498 kJ =1443kJ���ɼ��ų���������Ϊ2mol��630 kJ/mol=1260 kJ���ų�������С�����յ�����������1mol N2��1molO2��ȫ��Ӧ����NO��������1443kJ-1260kJ=183kJ��������
(2) ����ͼ���֪�� Y�����ʵ��������࣬X�����ʵ������٣���XΪ��Ӧ�YΪ���������ȵ�ʱ����X��Y�����ʵ����仯֮��Ϊ0.6:0.3=2:1�����Է�Ӧ����ʽӦΪ��2XY��
�ڸ���![]() 0.2mol/(L��min)��
0.2mol/(L��min)��
��a��2XY��Ӧǰ���������ʵ����DZ������ں�����������ѹǿ�DZ�������ѹǿ���ٷ����仯һ��ƽ�⣬��ѡa��
b��X������������ٷ����仯��˵��X��Ũ�Ȳ��ٱ仯��һ���ﵽƽ��״̬����ѡb��
c�����������غ㣬ԭ�������Ǻ�����������ԭ���������ٷ����仯����һ��ƽ�⣬�ʲ�ѡc��
d����ͬʱ��������nmolY��ͬʱ����2nmol X�������淴Ӧ���ʣ������Ƴ����淴Ӧ������ȣ���һ��ƽ�⣬��ѡd��
�ܽ����¶ȷ�Ӧ���ʼ�С�����Է�Ӧ�ﵽƽ����������¶ȣ����(��)��С����(��)��С��
(3) �٦� (A) ��1=0.015mol (Ls)��1��1=0.015mol (Ls)��1��
�ڦ� (B) ��3=0.09mol (Ls)��1��3=0.03mol (Ls)��1
�ۦ� (C) ��2=2.4mol (Lmin )��1��2=1.2mol (Lmin )��1=0.02 mol (Ls)��1
�ܦ� (D) ��3=0.045mol (Ls)��1��3=0.015mol (Ls)��1�������ɴ�С��˳��Ϊ��>��>��=�ܡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 �桢101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22��68 kJ,�����Ȼ�ѧ����ʽ��ȷ����
A. CH3OH��l����3/2O2(g) ![]() CO2(g)+2H2O(l) ����H=+725��8 kJ��mol��1
CO2(g)+2H2O(l) ����H=+725��8 kJ��mol��1
B. 2CH3OH��l��+3O2(g) ![]() 2CO2(g)+4H2O(l) ����H=��1 452 kJ��mol��1
2CO2(g)+4H2O(l) ����H=��1 452 kJ��mol��1
C. 2CH3OH(l)+3O2(g) ![]() 2CO2(g)+4H2O(l) ����H=��725��8 kJ��mol��1
2CO2(g)+4H2O(l) ����H=��725��8 kJ��mol��1
D. 2CH3OH��l��+3O2(g) ![]() 2CO2(g)+4H2O(l) �� ��H=+1 452 kJ��mol��1
2CO2(g)+4H2O(l) �� ��H=+1 452 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO(g)��H2O(g)��Ӧ�������仯��ͼ��ʾ���й����߷�Ӧ��˵����ȷ����(����)

A. �÷�ӦΪ���ȷ�Ӧ
B. �÷�Ӧ����Ҫ���Ⱦ��ܽ���
C. 1 molCO(g)��1mol H2O(g)�������������1 molCO2(g)��1 molH2(g)���������
D. 1 molCO2(g)��1 molH2(g)��Ӧ����1 molCO(g)��1mol H2O(g)Ҫ�ų�41 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2��+8H2O
ʵ���� | 0.1mol/L����KMnO4��Һ�����/mL | 0.6mol/LH2C2O4��Һ�����/mL | H2O�����/mL | ʵ���¶�/�� | ��Һ��ɫ����ʱ��/min |
�� | 10 | V1 | 35 | 25 | |
�� | 10 | 10 | 30 | 25 | |
�� | 10 | 10 | V2 | 50 |
��1������V1=_______mL��V2=_______mL��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________mol��L��1��min��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯����������ͼ��ʾ����������ȷ����

A. ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158 mol/(Ls)
B. ��Ӧ��ʼ��10s��X�����ʵ���Ũ�ȼ�����0.79 mol/L
C. ��Ӧ��ʼ��10s��Y��ת����Ϊ79.0 %
D. ��Ӧ�Ļ�ѧ����ʽΪ��X��Y![]() Z
Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��ԭ��������������������Ԫ�طֱ�λ�ڲ�ͬ�����壬���ǵĵ��ʳ����¾�����̬��X��Y��W���ڲ�ͬ���ڣ�����һ���������䵥���ܷ�����Ӧ��X2+Y2���ף�X2+W2���ң���֪���ס��ҳ����¾�Ϊ��̬���������ڿ���������ʱ�ɻ��ϳɱ����Իش��������⣺
�� Y��Z��Ӧ���⻯��Ƚ��ȶ����ǣ�_______________��(�ѧʽ)
�� �����������_____________����(�������)����ˮ��Һ�����ԣ������ӷ���ʽ��ʾ��ԭ��_________________________________________��
�� X��Z�������ԭ�ӻ����ﶡ�����������Ļ�ѧ������Ϊ��____________������˵�������ﶡ��һ�ֳ�����;��___________________________________ ��
�� X��Y��ɵ�Һ̬������Y2X4 16 g����������Ӧ����Y2��Һ̬ˮ���ų�QkJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��______________________________��
Y2X4�����Ժ�Z2��������Ч��ȼ�ϵ�أ����������ҺΪNaOH��Һ���������ĵ缫��ӦʽΪ��________________________________________ ��
�� һ�������£�ȡ 3.4 g����������1 L���ݵ������У�4���Ӻ������ڵ�ѹǿ��Ϊԭ����1.2�����Ҳ��ٱ仯���÷�Ӧ�м������ת����Ϊ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3molA�����1.5molB������3L�������л�ϲ���һ�������������·�Ӧ�� 2A(g)+B(g) ![]() 2C(g)����2s����C��Ũ��Ϊ0.3mol/L�������м�����ȷ���ǣ�
2C(g)����2s����C��Ũ��Ϊ0.3mol/L�������м�����ȷ���ǣ�
����A��ʾ��ƽ����Ӧ����Ϊ0.3mol/��L��s��
��2sʱ����A��Ũ��Ϊ0.7mol/L
����B��ʾ��ƽ����Ӧ����Ϊ0.15mol/��L��s��
��2sʱ����B��ת����Ϊ30��
A. �ڢ�B. �٢�C. �ڢ�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. ![]() He ��
He �� ![]() He ��Ϊͬλ�أ��ֱ��� 3 �� 4 ������
He ��Ϊͬλ�أ��ֱ��� 3 �� 4 ������
B. O2 �� O3 ��Ϊͬ�������壬ͬ������ʱ��������������ͬ
C. 1 mol ��ˮ�� 1 mol ˮ�У���������Ϊ 2��1
D. 1 mol ����� 1 mol ��ϩ�У����õ��Ӷ�����ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com