
【题目】下列叙述正确的是
A. ![]() He 和
He 和 ![]() He 互为同位素,分别含有 3 和 4 个中子
He 互为同位素,分别含有 3 和 4 个中子
B. O2 和 O3 互为同素异形体,同等质量时,所含电子数相同
C. 1 mol 重水与 1 mol 水中,中子数比为 2∶1
D. 1 mol 乙烷和 1 mol 乙烯中,共用电子对数相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在人们的生活经常出现
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会_______________(填“吸收”或“放出”)________kJ能量。
(2)一定温度下,在体积为0.5 L的恒容密闭容器中,氮的气态氧化物X和Y之间反应过程中各物质的物质的量与时间的关系如图所示。
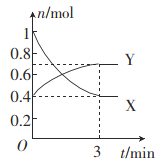
①该反应的化学反应方程式:______________________。
②在0~3 min内,用Y表示的反应速率为____________。
③下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.X的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolY的同时生成2nmol X
④反应达到平衡后,若降低温度,则υ(正)______,υ(逆)________。(填“增大”“减小”或“不变”)。
(3)反应 A(g)+3B(g)═2C(g)+3D(g)在四种不同情况下的反应速率分别为:
①υ (A)=0.015mol (Ls)﹣1 ②υ (B)=0.09mol (Ls)﹣1
③υ (C)=2.4mol (Lmin )﹣1 ④υ (D)=0.045mol (Ls)﹣1
该反应在四种不同情况下速率由大到小的顺序为(用序号填空)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)![]() N2O4(g);△H<0。则以下说法不正确的是
N2O4(g);△H<0。则以下说法不正确的是
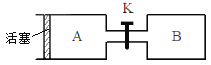
A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种常见有机物之间的转化关系图。C具有果香味。

根据以上信息及各物质的转化关系完成下列各题:
(1)A的结构简式为_______,工业上用乙烯生产A的化学方程式为__________。
(2)B的官能团名称为_____,B可与纯碱溶液反应,写出该反应方程式_____________。
(3)A+B→C的化学方程式为__________,反应类型为_________反应。
(4)下列说法正确的是_______。
a.上述有机物中只有C6H12O6属于糖类物质
b.物质A和B都属于电解质
c.物质C和油脂类物质互为同系物
d.转化1可在人体内完成,该催化剂属于蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g) ![]() x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】劣质洗发水中含有超标致癌物二噁烷![]() 。关于该化合物的说法正确的是
。关于该化合物的说法正确的是
A. 与 1,4-丁二醇(CH2OHCH2CH2CH2OH)互为同分异构体
B. l mol 二噁烷完全燃烧消耗 5molO2
C. 分子中所有原子均处于同一平面
D. 一氯代物有 4 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
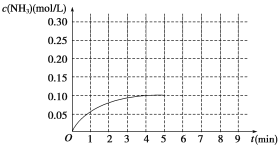
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+2B(g)![]() 2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”“减小”或“不变”)填入空格。
(1)升高温度,B的转化率________,v(正)________,v(逆)________。
(2)加正催化剂,A的物质的量____________,v(正)________,v(逆)________。
(3)保持温度和压强不变,加入稀有气体,则C的物质的量________,A的转化率________。
(4)保持温度和体积不变,加入稀有气体,A的转化率________。
(5)若温度和体积不变,反应从开始到平衡,容器内气体的密度________,压强________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com