
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源.甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景.回答下列问题:
(1)![]() 与
与![]() 合成甲醇:
合成甲醇:![]() 但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现
但是找到合适的催化剂是制约该方法的瓶颈.目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险.最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现![]() 电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.
电催化还原制备甲醇方向取得重要进展,该反应历程如图所示.

容易得到的副产物有CO和![]() ,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________
,其中相对较多的副产物为________________;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中________![]() 填字母
填字母![]() 的能量变化.
的能量变化.
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(2)恒压![]() 容器的容积可变
容器的容积可变![]() 下,
下,![]() 与
与![]() 在催化剂作用下发生反应
在催化剂作用下发生反应![]()
![]() ,
,![]() 的平衡转化率与温度、压强的关系如图所示.
的平衡转化率与温度、压强的关系如图所示.

①压强![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
②在![]() 、
、![]() 条件下,b点时
条件下,b点时![]() ________
________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() .
.
③已知:反应速率![]() ,
,![]() 、
、![]() 分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为
分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为![]() ,计算b处的
,计算b处的![]() ________
________![]() 保留3位有效数字
保留3位有效数字![]() .
.
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应![]() Ⅰ
Ⅰ![]() 、
、![]() Ⅱ
Ⅱ![]() 的
的![]() 为以分压表示的平衡常数
为以分压表示的平衡常数![]() 与T的关系如下图所示.
与T的关系如下图所示.

①反应![]() Ⅱ
Ⅱ![]() 的
的![]() ________
________![]() 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”![]() .
.
②![]() 点时,反应
点时,反应![]() 的
的![]() ________
________![]() 填数值
填数值![]() .
.
③在恒容密闭容器中充入![]() 、
、![]() 只发生反应
只发生反应![]() Ⅱ
Ⅱ![]() ,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入
,图中d点处达到平衡时,CO的转化率为________;达到平衡时,向容器中再充入![]() 、
、![]() ,重新达到平衡时,CO的平衡转化率________
,重新达到平衡时,CO的平衡转化率________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() .
.
【答案】![]() A
A ![]()
![]()
![]() 小于
小于 ![]()
![]() 不变
不变
【解析】
(1)由图可知生成副产物![]() 的能量变化大,即能垒高,反应进行难,生成的量少,所以其中相对较多的副产物为CO;由图可知生成甲醇的过程中,能垒最高的变化为
的能量变化大,即能垒高,反应进行难,生成的量少,所以其中相对较多的副产物为CO;由图可知生成甲醇的过程中,能垒最高的变化为![]() ,该反应速率最慢,所以要想提高整个反应速率,应该降低该反应的能垒,故选A,
,该反应速率最慢,所以要想提高整个反应速率,应该降低该反应的能垒,故选A,
故答案为:CO;A;
(2)①因为该反应为气体分子数减小的反应,所以压强越大,二氧化碳的转化率越大,相同温度下,![]() 时
时![]() 的转化率比
的转化率比![]() 时的大,所以压强
时的大,所以压强![]() ;
;
![]() 在
在![]() 、
、![]() 条件下,a点为平衡点,与a点相比,b点的二氧化碳转化率较低,此时正反应速率大于逆反应速率;
条件下,a点为平衡点,与a点相比,b点的二氧化碳转化率较低,此时正反应速率大于逆反应速率;
![]() 根据三段式可求出a点平衡时各成分的量
根据三段式可求出a点平衡时各成分的量

故![]() ,
,![]() ,此时v正=v逆,故
,此时v正=v逆,故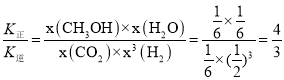 ;
;
b点根据三段式可得:

此时,
故答案为:![]() ;
;![]() ;
;![]()
(3)![]() 反应
反应![]() 的
的![]() 随温度的升高而减小,所以
随温度的升高而减小,所以![]() ;
;
![]() 点时,两者的平衡常数相等,即
点时,两者的平衡常数相等,即![]() ,化简可得
,化简可得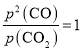 ,反应
,反应![]() 的
的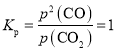 ;
;
![]() 点时,反应
点时,反应![]() 的
的![]() ,
,
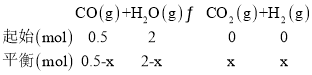
 表示容器内气体的总压强
表示容器内气体的总压强![]() ,
,![]() ,
,![]() ,所以CO的转化率为
,所以CO的转化率为![]() ,该反应反应前后气体分子数不变,再充入的气体在另一相同的容器中达到平衡后,压缩到前一容器中,过程中平衡不移动,
,该反应反应前后气体分子数不变,再充入的气体在另一相同的容器中达到平衡后,压缩到前一容器中,过程中平衡不移动,
故答案为:![]() 小于;
小于;![]() ;
;![]() ;不变。
;不变。


科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。实验结论:A的相对分子质量为_____。
(2)将9.0g A在足量O2中充分燃烧,并使其产物依次缓缓通过足量浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为_____。
(3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况)。用结构简式表示A中含有的官能团:_____________________。
(4)A的核磁共振氢谱如图。则A中含有_____种氢原子。
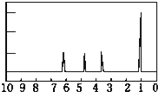
(5)综上所述,A的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。
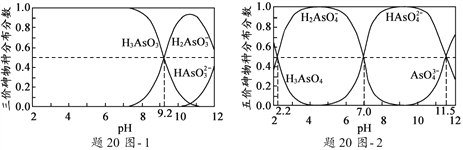
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液的pH均大于7,相同浓度A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
(1)A是___,B是___。
(2)写出C与D反应的离子方程式___。
(3)25℃时,0.1mol·L-1B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=___(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为___。
(5)在一定体积的0.005mol·L-1的C溶液中,加入一定体积的0.00125mol·L-1的盐酸时,混合溶液的pH=11,若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ. (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷脱氢是工业生产丙烯的重要途径,其热化学方程式为![]()
![]() ,请回答下列相关问题。
,请回答下列相关问题。
![]() 下表为部分键能数据,据此可算出
下表为部分键能数据,据此可算出![]() ___________
___________![]() 。
。
化学键 |
|
|
|
|
键能 | 332 | 611 | 414 | 436 |
![]() 一定温度下,向
一定温度下,向![]() 的密闭容器中充入
的密闭容器中充入![]() 发生脱氢反应,经过
发生脱氢反应,经过![]() 达到平衡状态,测得平衡时气体压强是开始的
达到平衡状态,测得平衡时气体压强是开始的![]() 倍。
倍。
![]() 内氢气的生成速率
内氢气的生成速率![]() _______,
_______,![]() 的平衡转化率为_______。
的平衡转化率为_______。
![]() 下列情况能说明该反应达到平衡状态的是____________
下列情况能说明该反应达到平衡状态的是____________![]() 填标号
填标号![]() 。
。
A.混合气体的平均相对分子质量保持不变 ![]() 与
与![]() 的物质的量之比保持不变
的物质的量之比保持不变
C.混合气体的密度保持不变 ![]() 的分解速率与
的分解速率与![]() 的消耗速率相等
的消耗速率相等
![]() 脱氢反应分别在压强为
脱氢反应分别在压强为![]() 和
和![]() 时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
时发生,丙烷及丙烯的平衡物质的量分数随温度变化如图所示:
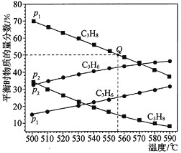
![]() 压强:
压强:![]() _________
_________![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___________。
![]() 若
若![]() ,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数
,起始时充入丙烷发生反应,则Q点对应温度下,反应的平衡常数![]() _______
_______![]() 用平衡分压代替平衡浓度计算,分压
用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
实际生产中常在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氧反应,充入氩气的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林(化学名称为乙酰水杨酸)是具有解毒、镇痛等功效的家庭常备药,科学家用它连接在高分子载体上制成缓释长效阿司匹林,其部分合成过程如下:
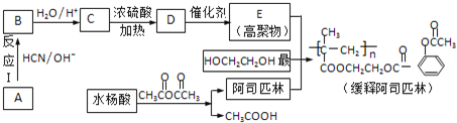
已知:醛或酮均可发生下列反应:CH3CHO ![]()
(1)水杨酸的化学名称为邻羟基苯甲酸,则水杨酸的结构简式为__;
(2)反应Ⅰ的反应类型是__反应.HOCH2CH2OH可由1,2﹣二溴乙烷制备,实现该制备所需的反应试剂是__;
(3)写出C→D的反应方程式______;
(4)C可发生缩聚反应生成高聚物,该高聚物的结构简式为____;
(5)阿司匹林与甲醇酯化的产物在氢氧化钠溶液中充分反应的化学方程式为______;
(6)下列说法正确的是__;
a.服用阿司匹林出现水杨酸中毒,应立即停药,并静脉注射NaHCO3溶液
b.1mol HOCH2CH2OH的催化氧化产物与银氨溶液反应,理论上最多生成2mol银
c.A的核磁共振氢谱只有一组峰
d.两分子C发生酯化反应可生成8元环状酯
(7)写出缓释阿司匹林在体内水解生成阿司匹林、高聚物E等物质的反应方程式__;
(8)水杨酸有多种同分异构体,其中属于酚类且能发生银镜反应的同分异构体有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中正确的是()
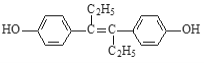
A.遇FeCl3溶液不能发生显色反应
B.可与NaOH和NaHCO3溶液发生反应
C.1mol该有机物可以与5molBr2发生反应
D.己烯雌酚分子中一定有16个碳原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际奥委会公布的违禁药物有138种,其中某种兴奋剂分子结构如图,关于它的说法正确的是( )

A. 该物质属于芳香烃
B. 该分子中所有碳原子共面
C. 1mol该物质与氢氧化钠溶液完全反应,最多消耗2molNaOH
D. 该物质的化学式为C15H24ClNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com