
【题目】如果把![]() 的相对原子质量定义为24,以
的相对原子质量定义为24,以![]() 所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
所含的C原子数为阿伏加德罗常数,则在标准状况时下列数值肯定不变的是( )
A.浓硫酸(![]() )的物质的量浓度
)的物质的量浓度
B.常温下氯化钠的溶解度
C.标准状况下气体摩尔体积.
D.1克拉钻石所含的C原子的物质的量
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断错误的是( )
A.NA个H+的质量为1 g
B.46g NO2和N2O4混合气体所含氧原子数目为2NA
C.在常温常压下,11.2L N2含有的分子数小于0.5NA
D.56g铁与足量的盐酸反应,转移的电子为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是合成氨反应的正、逆反应速率随反应时间变化的示图,有关叙述错误的是
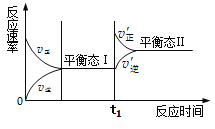
A. 状态Ⅰ和状态Ⅱ时,反应均处于平衡状态
B. 状态Ⅰ变化为状态Ⅱ的过程,称为化学平衡移动
C. t1时刻平衡向正反应方向移动,平衡常数增大
D. 同一种反应物在状态I和状态II时,浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度为2 mol/L的HCl溶液VL,欲使其浓度变为4 mol/L,下列方法可行的是( )
A. 通入标准状况下的HCl气体44.8 L
B. 将溶液加热蒸发浓缩至0.5V L
C. 加入10 mol/L盐酸0.6V L,再将溶液稀释至2V L
D. 蒸发掉0.5 L水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_______。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为__________________(不写反应条件),原子利用率是______________。
(3)属于乙醇的同分异构体的是_______(选填编号)。
A.![]() B.
B.![]() C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
C.甲醇 D.CH3—O—CH3 E.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗_______mol氧气。
② 乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的![]() 及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
及泥沙,可将粗盐溶于水,然后进行下列五项操作。正确的操作顺序是( )
①过滤 ②加过量![]() 溶液 ③加过量盐酸
溶液 ③加过量盐酸
④加热煮沸 ⑤加过量的![]() 溶液 ⑥过量
溶液 ⑥过量![]() 溶液。
溶液。
A.②⑤⑥①③④B.⑤②⑥③①④C.⑥②⑤③④①D.⑥②①⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:Ⅰ.RCOOR′+ R′′18OH![]() RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
RCO18O R′′+ R′OH(R、R′、R′′代表烃基);
Ⅱ. (R、R′代表烃基);
(R、R′代表烃基);
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d.1 mol 与足量NaOH溶液反应时,最多消耗4 mol NaOH
与足量NaOH溶液反应时,最多消耗4 mol NaOH
(7)J的某种同分异构体与J具有相同官能团,且为顺式结构,其结构简式是________。
(8)写出由PET单体制备PET聚酯(化学式为C10nH8nO4n 或C10n+2H8n+6O4n+2)并生成B的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g);
2SO3(g); ![]() 。实验测得起始、平衡时的有关数据如下表:
。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是 ( )
A.Q1=Q2=Q3="197" kJ
B.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ·mol-1
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com