
【题目】下列说法中正确的是
A. 6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
B. 某金属阳离子的结构示意图为![]() ,其与Cl-形成的强电解质都是离子化合物
,其与Cl-形成的强电解质都是离子化合物
C. 二硫化碳的电子式为![]()
D. 中子数为18的氯原子可表示为18Cl
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL(溶液体积有简单叠加),Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. c、d两点,![]() 值相等
值相等
C. a→d点过程中,存在c(X-)=c(NH4+)
D. b点,c(NH4+)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期M、N两种元素对应的简单离子分别为mMa+、n Nb-,若离子的核外电子排布相同,则下列关系不正确的是( )
A. 原子半径:M < NB. 离子半径:M < N
C. 原子序数:M > ND. 主族序数:M < N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
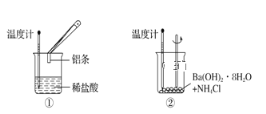
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某阴离子Rn- 的核外共有x个电子,核内有a个中子,则R的质量数为( )
A. a+x-n B. a+x+n C. a-x-n D. a-x+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别表示生物体内的生物大分子的部分结构模式图,据图回答:
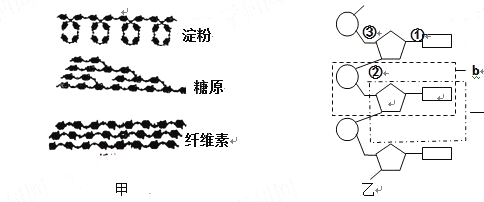
(1)甲图中的三种物质都是由许多 连接而成的,其中属于植物细胞中的储能物质是 。这三种物质中,在功能上与另外两种截然不同的是 ,这种物
质参与细胞中 的构成。
(2)乙图所示化合物的基本组成单位可用图中字母 表示,各基本单位之间是通过 (填①、②或③)连接起来的。
(3)由b形成的多聚体能储存大量的遗传信息,原因是 的排列方式是多样的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铝的性质,错误的说法是( )
A.铝的表面能形成致密的氧化膜,因此铝难腐蚀
B.铝能溶解于冷的浓硝酸氧化成为硝酸铝
C.铝能溶解于NaOH溶液生成偏铝酸钠和氢气
D.铝能在氯气中燃烧,生成氯化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有常温下pH=2的HCl溶液甲和pH=2的CH3COOH溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是_____。
A.c(H+) B.![]() C.c(H+)·c(OH-)
C.c(H+)·c(OH-)
(2)取10mL的乙溶液,加入等体积的水,CH3COOH的电离平衡________(填“向左”“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后溶液体积保持不变),待固体溶解后,溶液中![]() 的比值将________(填“增大”“减小”或“无法确定”)。
的比值将________(填“增大”“减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗NaOH溶液体积的大小关系为V(甲)________(填“>”“<”或“=”)V(乙)。
(4)已知25℃时,下列酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=4.7×10-11 | 3.0×10-8 |
下列四种离子结合H+能力最强的是________。
A.HCO B.CO![]() C.ClO- D.CH3COO-
C.ClO- D.CH3COO-
写出下列反应的离子方程式:HClO+Na2CO3(少量):______________________
II.室温下,0.1 mol·L-l的KOH溶液滴10.00mL 0.10 mol·L-l H2C2O4 (二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
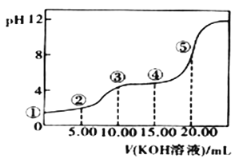
(5)点③所示溶液中所有离子的浓度由大到小的顺序为:________________________。点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4)+c(C2O42)=________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近两年流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式如图,下列说法不正确的是( )
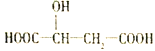
A. 苹果酸在一定条件下能发生酯化反应
B. 苹果酸在一定条件下能发生催化氧化反应
C. 1mol苹果酸与足量金属钠反应最多可以产生1.5mol H2
D. 1mol苹果酸与NaHCO3溶液反应最多消耗3mol NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com