
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
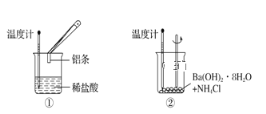
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
【答案】b a b Li2O
【解析】
(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应;
(2)金属与酸反应放热;
(3)断裂化学键吸热、形成化学键放热;
(4)锂的活泼性小于钠;
(1)氢氧化钡晶体与氯化铵晶体混合,是典型的吸热反应,所以装置②中反应后溶液的温度降低,选b;
(2)铝与盐酸是放热反应,所以反应物的总能量比生成物的总能量高,故选a;
(3)反应H2+I2=2HI断裂化学键吸收的能量为436kJ+151 kJ=587 kJ,形成化学键放出能量299kJ×2=598 kJ,放出的能量大于吸收的能量,所以反应放热,选b;
(4)钠在空气中燃烧生成Na2O2,锂的活泼性小于钠,所以锂单质在空气中燃烧的产物应为Li2O。


科目:高中化学 来源: 题型:
【题目】某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
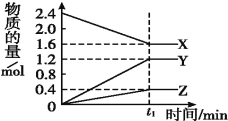
(1)①该反应的化学方程式是_______________________________。
②在t1 min时,该反应达到了____状态,下列可作为判断反应已达到该状态的是____。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.生成3 mol Y的同时生成1 mol Z D.生成1 mol Z的同时生成2 mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为____:在此t1 min时间内,用H2表示反应的平均速率v(H2)为_________。
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为说法中正确的是____同学。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能大量存在:H+、Na+、Fe2+、Al3+、NH4+、SO42-、Cl-中的几种离子,现进行了如下实验:
① 取该溶液10.0mL,加入过量Ba(NO3)2溶液,产生白色沉淀x和无色气体a,a遇空气立即变为红棕色气体b;过滤。
② 向①所得的滤液中加入过量NaOH溶液,产生红褐色沉淀y,过滤,加热滤液有无色刺激性气体c生成;用铂丝蘸取滤液,在火焰上灼烧,火焰呈黄色。
③ 向②所得的滤液中通入过量CO2气体有白色沉淀z生成。
下列推断错误的是
A. 原溶液一定只含有:Na+、Fe2+、Al3+、SO42-
B. 实验① 的红棕色气体b中存在:2NO2![]() N2O4。
N2O4。
C. 实验② 中产生沉淀y的反应:Fe3++3OH-=Fe(OH)3↓
D. 实验③ 中CO2先后分别与NaOH(aq)、NaAlO2(aq)反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
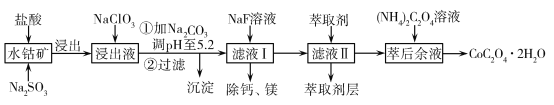
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO不会氧化Co2+,ClO转化为Cl-;③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2 HC2O4-
H++HC2O4- Ka1=5.4×10-2 HC2O4-![]() H++C2O42- Ka2=5.4×10-5
H++C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH________7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水
C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
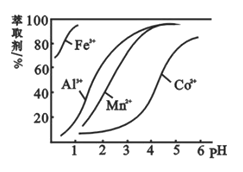
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A.1 mol O3的质量为 32 gB.SO42-的摩尔质量为96 g/mol
C.0.05mol HCl的体积是1.12LD.0.5mol/L Al2(SO4)3溶液中含Al3+的个数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H ( )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同
B. 某金属阳离子的结构示意图为![]() ,其与Cl-形成的强电解质都是离子化合物
,其与Cl-形成的强电解质都是离子化合物
C. 二硫化碳的电子式为![]()
D. 中子数为18的氯原子可表示为18Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。纵坐标p(Mn+)表示-lgc(Mn+),横坐标p(S2-)表示-lgc(S2-),下列说法不正确的是( )
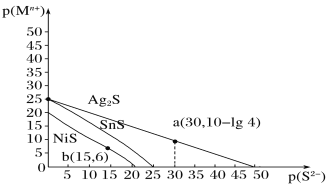
A. 该温度下,Ag2S的Ksp=1.6×10-49
B. 该温度下,溶解度的大小顺序为NiS>SnS
C. SnS和NiS的饱和溶液中![]() =104
=104
D. 向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com