
【题目】某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
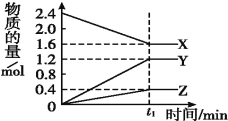
(1)①该反应的化学方程式是_______________________________。
②在t1 min时,该反应达到了____状态,下列可作为判断反应已达到该状态的是____。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为2∶3
C.生成3 mol Y的同时生成1 mol Z D.生成1 mol Z的同时生成2 mol X
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为____:在此t1 min时间内,用H2表示反应的平均速率v(H2)为_________。
②两位同学讨论放热反应和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为说法中正确的是____同学。
【答案】2X![]() 3Y+Z 平衡 D 36.8kJ 0.6/t1 mol/(Lmin) 乙
3Y+Z 平衡 D 36.8kJ 0.6/t1 mol/(Lmin) 乙
【解析】
(1)根据物质的变化量之比是化学计量数之比分析解答;结合平衡状态的特征分析判断;
(2)根据反应热结合图像计算反应吸热的热量;根据化学反应速率的含义计算反应速率;
(3)根据影响反应热的因素分析解答。
(1)①根据图像,X为反应物,Y和Z为生成物,t1 min时消耗X0.8mol,生成Z是0.4mol,生成Y是1.2mol,根据化学计量数之比等于物质的量变化之比可知该反应方程式为2X![]() 3Y+Z;
3Y+Z;
②根据图像可知在t1min时反应达到平衡;A、没有指明反应速率的方向,无法判断是否反应达到平衡状态,故A错误;B、X、Y的反应速率比为2∶3不能说明正逆反应速率相等,因此不能说明反应达到化学平衡状态,故B错误;C、反应都是向正反应方向进行,因此不能说明反应达到平衡,故C错误;D、生成1molZ,说明反应向正反应方向进行,生成2molX,说明反应向逆反应方向进行,且生成量比值等于化学计量数之比,因此能够说明反应达到平衡,故D正确;答案选D。
(2)①已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,至t1 min时消耗氨气0.8 mol,则该反应吸收的热量为0.8×46 kJ=36.8 kJ;在此t1 min时间内生成氢气是1.2mol,浓度是0.6mol/L,则用H2表示反应的平均速率为v(H2)为0.6/t1 mol/(Lmin);
②有些放热反应也需要加热,如铝热反应,因此甲同学说法错误,要持续加热才能进行的反应是吸热反应,故乙同学说法正确。


科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期数与主族序数相等。
请回答下列问题:
![]()
(1)W在周期表中的位置是___________________________________,Q、R、T三种元素原子半径由大到小的顺序为________________________________。(用元素符号表示),
(2)QO2的电子式为_______________,R的最高价氧化物的化学式___________。
(3)T单质与NaOH 溶液反应的离子方程式为______________________
(4)T单质与W最高价氧化物的水化物溶液反应的离子方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大:_____min(填0~1、1~2、2~3、3~4、4~5),原因是________。
②求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率___________________ (设溶液体积不变)。
(2)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
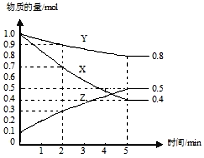
①该反应的化学方程式是___________。
②该反应达到平衡状态的标志是________
A.X的浓度不再改变
B.生成1mol Y的同时消耗2mol Z
C.Y的体积分数在混合气体中保持不变
D.容器内气体的总质量保持不变
③2min内Y的转化率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-===CO32-+7H2O;Y极:4H2O+2O2+8e-===8OH-。下列关于此燃料电池的说法中,错误的是( )
A. X为负极,Y为正极
B. 工作一段时间后,KOH的物质的量减少
C. 在标准状况下,通入5.6 L O2完全反应后,有1 mol电子发生转移
D. 该电池工作时,X极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学实验室用如图所示装置制取少量溴苯。请填写下列空白。
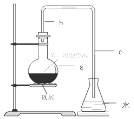
(1)在烧瓶a中装的试剂是苯、溴和铁屑。导管b的作用有两个:一是导气,二是兼起__________的作用。
(2)反应过程中在导管c的下口附近可以观察到白雾出现,这是由于反应生成的________遇水蒸气而形成的。
(3)反应完毕后,向锥形瓶d中滴入AgNO3溶液,有__________生成。
(4)反应完毕后,将烧瓶a中的液体倒入盛有冷水的烧杯里,可以观察到烧杯底部有__________色不溶于水的液体。这是溶解了__________的粗溴苯。
(5)写出烧瓶a中发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HX溶液与NH3·H2O溶液按不同体积比混合,保持Va+Vb=100mL(溶液体积有简单叠加),Va、Vb与混合液的pH的关系如图所示。下列说法不正确的是

A. Ka(HX)的值与Kb(NH3·H2O)的值相等
B. c、d两点,![]() 值相等
值相等
C. a→d点过程中,存在c(X-)=c(NH4+)
D. b点,c(NH4+)+c(HX)=0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
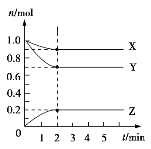
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如图所示实验,以检验化学反应中的能量变化。
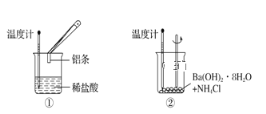
(1)实验发现,装置②中反应后溶液的温度________。
a.升高 b.降低 c.不变
(2)装置①中发生的反应,反应物的总能量比生成物的总能量_________。
a.高 b.低 c.相等
(3)已知断裂1 mol共价键需要吸收的能量分别为H-H:436kJ,I-I:151 kJ,H-I:299kJ。则反应H2+I2=2HI的能量变化为_______。
a.吸热 b.放热 c.无能量变化
(4)碱金属单质在空气中燃烧的产物与碱金属的活泼性有关。若某同学做了锂单质在空气中燃烧的实验,他得到的产物应为_____。(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com