
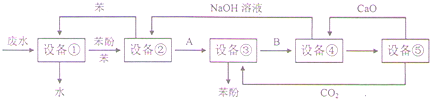


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
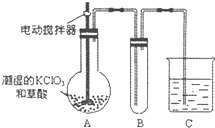 用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯、铁酸钠(Na2FeO4)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术,ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:
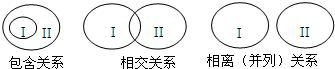 大多数概念间存在如图三种关系:
大多数概念间存在如图三种关系:| 概念I | 概念II | 相互关系 | |
| A | 无机酸 | 离子化合物 | 包含关系 |
| B | 胶体 | 分散系 | 相交关系 |
| C | 非金属氧化物 | 酸性氧化物 | 相离(并列)关系 |
| D | 复分解反应 | 氧化还原反应 | 相离(并列)关系 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
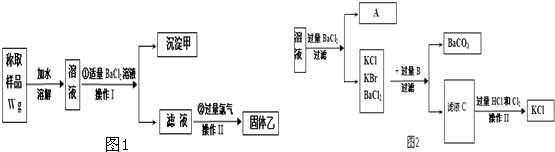
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
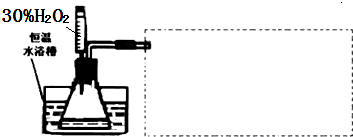
| 实验序号 | V[Fe2(SO4)3]/mL | V(H2O2)/mL | V(蒸馏水)/mL | 时间t/min | V(氧气)/mL |
| 1 | 1.0 | 10.0 | 5.0 | 2.0 | 10.0 |
| 2 | 2.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com