
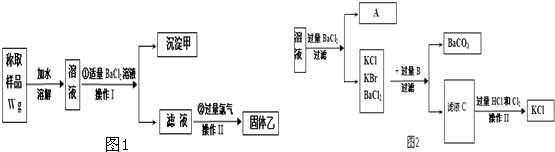
| W1g |
| 233g/mol |
| W1 |
| 233 |
| W1 |
| 233 |
| W1 |
| 233 |
| 174 |
| 233 |
| 149 |
| 233 |
| 149 |
| 233 |
| 174 |
| 233 |
| 149 |
| 233 |
| 238 |
| 89 |
| 25W1 |
| 233 |
| m(KBr) |
| W |
| 238 |
| 89W |
| 25W1 |
| 233 |
| 238 |
| 89W |
| 25W1 |
| 233 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠块沉在乙醇液面的下面 |
| B、反应较为和缓 |
| C、钠块在乙醇的液面上游动 |
| D、钠块表面有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3溶液有杀菌消毒作用 |
| B、FeCl3溶液能使血液聚集沉降 |
| C、FeCl3溶液能产生Fe(OH)3沉淀堵住伤口 |
| D、FeCl3能使血液发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | Ca2+、Mg2+总浓度 | 细菌总数 |
| 6.5~8.5 | <0.0045mol?L-1? | <100个?mL-1? |
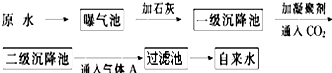
查看答案和解析>>
科目:高中化学 来源: 题型:
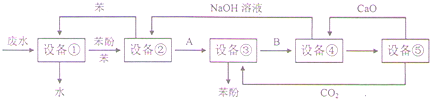
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A与B互为同分异构体 |
| B、A与B的分子组成相差n个“CH2” |
| C、A与B的分子组成相差n个“CO2” |
| D、A与B的分子组成相差n个“H2O” |
查看答案和解析>>
科目:高中化学 来源: 题型:
 地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题:
地球是一个巨大的生态系统,森林对保护改善人类的生存环境有着十分重要的作用.科学实验证明,1公顷柳杉林每月可以吸收SO2160kg,试解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
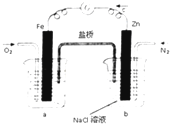
| A、烧杯a中的溶液pH减小 |
| B、烧杯b中发生氧化反应 |
| C、烧杯a中发生的反应为2H++2e-=H2↑ |
| D、烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com