
【题目】有机物H (结构简式为 )是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为
)是合成高分子化合物M的单体,H可以通过有机物A (分子式为C7H8O) 和丙酮为原料来进行合成,E为中间产物(结构简式为 )其合成路线如图:
)其合成路线如图:

己知:![]()
请回答下列问题:
(1)A的名称为_________,G 中含氧官能团的名称是________________;①的反应类型是__________。
(2)检验有机物A中官能团的方法为______________________________。
(3)高分子化合物M 的结构简式为____________________。
(4)反应③的化学反应方程式为______________________________。
(5)有机物C有多种同分异构体,其中苯环上只有两个侧链的芳香酯的同分异构体有__________种
(6)已知: ,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
,以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,此合成路线为
,此合成路线为 ,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________
,请完成接下来的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上下注明试剂和反应条件)。____________
【答案】 邻甲(基)苯酚(或2-甲基苯酚) 醚键、羧基 加成反应 取少量A于试管中,向其中滴加氯化铁溶液,溶液显紫色(或滴加浓溴水产生白色沉淀) 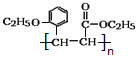
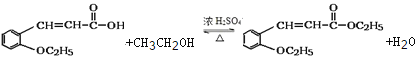 12种
12种 ![]()
【解析】有机物A分子式为C7H8O,由B与溴乙烷反应生成物(![]() )结构可知A为
)结构可知A为![]() ,B为
,B为![]() 。结合信息可知
。结合信息可知![]() 发生氧化反应生成C,结合E的结构可知C为
发生氧化反应生成C,结合E的结构可知C为![]() ,C与丙酮发生加成反应生成E,由H、E的结构简式可知G为
,C与丙酮发生加成反应生成E,由H、E的结构简式可知G为 ,F为
,F为 。
。
(1)根据以上分析可知A的名称为邻甲(基)苯酚或2-甲基苯酚,G中含氧官能团的名称是醚键、羧基;①的反应类型是加成反应。(2)有机物A中含有酚羟基,检验酚羟基的方法为:向有机物A中滴加氯化铁溶液,溶液显紫色。(3)H发生加聚反应生成高分子化合物M的结构简式为 。(4)反应③的化学反应方程式为
。(4)反应③的化学反应方程式为 。(5)苯环上只有两个侧链的芳香酯,则如果酯基是-OOCH,则另一个取代基是乙基,如果酯基是-CH2OOCH,另一个取代基是甲基,如果酯基是-OOCCH3,另一个取代基是甲基,如果酯基是-COOCH3,另一个取代基是甲基,均有邻间对三种,共计是12种;(6)根据已知信息结合逆推法可知以2-溴丙烷和乙烯为原料合成有机物(CH3)2C=CHCH=C(CH3)2的路线为CH2=CH2
。(5)苯环上只有两个侧链的芳香酯,则如果酯基是-OOCH,则另一个取代基是乙基,如果酯基是-CH2OOCH,另一个取代基是甲基,如果酯基是-OOCCH3,另一个取代基是甲基,如果酯基是-COOCH3,另一个取代基是甲基,均有邻间对三种,共计是12种;(6)根据已知信息结合逆推法可知以2-溴丙烷和乙烯为原料合成有机物(CH3)2C=CHCH=C(CH3)2的路线为CH2=CH2![]() CH2BrCH2Br
CH2BrCH2Br![]()
![]() 。
。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去).常温下A、C、F是常见气体,A能使湿润的红色石蕊试纸变蓝,B是常见无色液体,C是导致“温室效应”的主要物质,E是白色沉淀,G是红褐色沉淀.X加热生成A、B、C的物质的量之比为2:1:1. 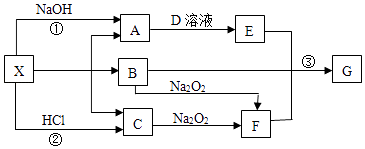
请回答下列问题:
(1)C的电子式为;
(2)X的化学式为;
(3)写出反应①的离子方程式:;
(4)写出反应③的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:

已知:(1)铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(2)溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为2Na2SiO3+2NaAlO2+2H2O=Na2A12Si2O8↓+4NaOH。请回答下列问题:
(1)铝土矿中Al2O3与氢氧化钠溶液反应的离子方程式为_________________________________。
(2)在工艺流程中“酸化”时,加入的最佳物质B是________,理由是_______________________,写出酸化过程发生反应的化学方程式:________________________________。
(3)工业上用Al2O3与C、Cl2在高温条件下反应制取AlCl3,理论上每消耗6.0 g碳单质,转移1 mol电子,则反应的化学方程式为__________________________________。
(4)某同学推测铝与氧化铁发生铝热反应得到的熔融物中还含有Fe2O3,设计了如下方案来验证:取一块该熔融物投入少量稀硫酸中,反应一段时间后,向反应后的混合液中滴加物质甲的溶液,观察溶液颜色的变化,即可证明熔融物中是否含有Fe2O3。
则物质甲是_________(填化学式),请判断该同学设计的实验方案的合理性_________(填“合理”或“不合理”)。原因是_______________________________________(若合理,则不用填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。

回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳衡量(总有机碳=![]() )。
)。
某学生兴趣小组用如下实验方法测定采集水样的总有机碳。

步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见右图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热,充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4===BaC2O4↓+2H2O,恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。____________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是__________________________________________。
(4)高温燃烧可将水样中的碳酸盐、碳酸氧盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;____________________________________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1molL﹣1的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”、“减小”或“不变”).
(填“增大”、“减小”或“不变”).
(2)若向氨水中加入稀硫酸,使其恰好完全中和,写出反应的离子方程式:;所得溶液的pH7(填“<”、“=”或“>”),用离子方程式表示其原因 .
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时 ![]() =a molL﹣1 ,
=a molL﹣1 , ![]() 则= .
则= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com