
【题目】下列与化学反应能量变化相关的叙述正确的是
A.生成物的总能量一定低于反应物的总能量
B.拆开物质中的化学键一定需要吸收能量
C.应用盖斯定律,无法计算某些难以直接测量的反应焓变
D.化学反应都伴随着能量和其他各种现象的出现
科目:高中化学 来源: 题型:
【题目】硫及许多化合物有很多重要的应用。
(1)古代四大发明之一的黑火药是由硫磺、木炭粉和__________按一定比例混合而成。
(2)黄铁矿的主要成分是FeS2,用于工业制取硫酸。生产硫酸经历三个生产阶段:
①第一阶段将黄铁矿粉末投入沸腾炉里与空气燃烧生成氧化铁等,其反应的化学方程式为__________________,氧化产物是_______________。
②第二阶段是在氧化炉中将S进行催化氧化。已知6.4g SO2气体完全氧化为SO3气体放出14.8kJ的热量。写出该反应的热化学方程式为________________________。工业上采用常压生产,则提高SO3产率的措施还有______________________(写2种即可)
(3)亚硫酸钠(Na2SO3)可用于生产饮用水作去氯剂,写出去氯(Cl2)的离子方程式:_____________。
(4)五水硫代硫酸钠(Na2S2O3·5H2O)是一种重要的化工原料。工业上的一种生产方法是将SO2通入由Na2S与Na2CO3按特定比例配成的混合液中并在合适温度下进行反应,然后经一系列工艺结晶获得。写出SO2通入Na2S与Na2CO3混合液发生反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠投入氯化亚铁溶液中:2Na+Fe2+===2Na++Fe
B. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
C. Fe3O4溶于稀硝酸中:Fe3O4+8H+===Fe2++2Fe3++4H2O ![]()
D. 澄清石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作正确的是
A. 用酸式滴定管量取 10.00 mL KMnO4溶液 B. 用 pH 试纸测定某氯水的 pH 为 3
C. 取下的分液漏斗的玻璃塞应倒放在桌面上 D. 用带胶塞的试剂瓶保存 CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.每摩尔物质约含有6.02×1023个粒子
B.摩尔是七个基本物理量之一
C.摩尔是物质的质量单位
D.摩尔是物质的数量单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯及其同系物的说法错误的是( )
A. 苯在空气中燃烧,火焰明亮伴有浓烟
B. 用酸性高锰酸钾溶液验证苯环上是否存在碳碳双键
C. 苯能与氢气在一定条件下发生加成反应
D. 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等。按要求回答下列问题:
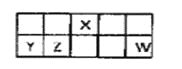
(1)写出W的离子结构示意图________________
(2)比较W 与Z的最高价氧化物对应水化物酸性的强弱 (写化学式)
(3)写出X的氢化物的电子式 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式_____________________
(4)已知:①C(s)+ O2(g)= CO2(g) △H="a" kJ· mol-1;
②CO2(g) +C(s)="2CO(g)" △H="b" kJ· mol-1;
③Si(s)+ O2(g)=SiO2(s) △H="c" kJ· mol-1。写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用电子式表示下列物质的形成过程:
①Na2S_________________; ②H2O________________
(2)写出下列物质的电子式:
③ KOH__________ ④CO2_______________。
(3)下列物质:①N2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩HBr。回答下列问题:(填序号)(每空2分,共10分)
只含极性键的是_______;含有极性键和非极性键的是_______;含有非极性键的离子化合物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个10 L的密闭容器发生反应A(g)+B(g) C(g)+D(g),测得平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | K | 0.6 | 0.4 |
回答下列问题:
(1)△H ____________ 0(填“<”或 “>”)。
(2)830℃时,向一个10 L的密闭容器中充入1mol的A和1mol的B,则:
①反应达平衡时,n (D)=0.5 mol,则A的平衡转化率为 ,
②该温度下平衡常数K= 。
(3)判断该反应是否达到平衡的依据为
a.c(A)不再改变 b.混合气体的密度不再改变
c.体系内压强不再改变 d.单位时间内生成C和消耗D的物质的量相等
(4)1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com