
����Ŀ���ڻ�ѧʵ������б���ע�ⰲȫ���������в������¹ʴ�����ȷ���ǣ� �� ���ڵ�ȼ��ȼ������ǰ�������������Ĵ���
����ϡ��Ũ����ʱӦ��Ũ��������������ע��ˮ�У����ò���������
��Ũ�����Ƥ���и�ʴ�ԣ��粻��մ��Ƥ���ϣ�Ӧ�ý϶��ˮ��ϴ����Ϳ������Һ
�ܸ��Թ��е�Һ�����ʱ��Һ������������Թ��ݻ�������֮һ
�ݵ�ȼʢ���ƾ��ľƾ��ƣ�
A.���٢�
B.���٢ڢ�
C.���٢ڢ�
D.ȫ��
���𰸡�C
���������⣺�ٵ�ȼ��ȼ����ǰ��һ��Ҫ�ȼ��������Ĵ��ȣ���ֹ��������ȼ����ը���ʢ���ȷ������ϡ��Ũ����ʱ����Ũ��������������ע��ˮ�У����ò��������Ͻ��裬���ܽ�ˮע��Ũ�����У���ˮ���ܶȱ�Ũ����Сˮ�ḡ��Ũ�������棬��Ũ��������ˮ��ų��������ȣ�ˮ����ڲ���Σ�գ��ʢ���ȷ��
��Ũ������ε�Ƥ���ϣ�Ӧ���ø�Ĩ����ȥ�����ô���ˮ��ϴ������3%��5%��NaHCO3��ҺͿ�ϣ��ʢ۴���
�ܸ��Թ���Һ����ȣ�Һ��һ�㲻�����Թ��ݻ��� ![]() ���ʢ���ȷ��
���ʢ���ȷ��
�ݲ�������ȼ�ŵľƾ��������Ӿƾ�����������ը���ʢݴ���
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС��������롰�о�����ˮ��Ӧ���ù������ʵijɷ֡����ʼ������á�ʵ��̽��������ͬ����������⣺
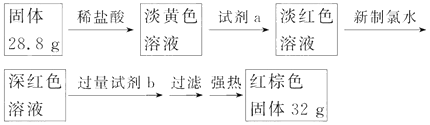
ͼ1 ͼ2
��1��̽��һ�������ͼ1��ʾװ�ý��С�����ˮ��Ӧ����ʵ�飮
a.Ӳ�ʲ�����B�з�����Ӧ�Ļ�ѧ����ʽΪ ��
b.��ӦǰA��Ͷ�����Ƭ��Ŀ���� ��
c.װ��E�е������� ��
��2��̽�������������ʵ�鷽��ȷ����Ӧ��Ӳ�ʲ�����B�к�ɫ����ijɷ֣�
a.��Ӳ�ʲ�����B��ȴ��ȡ�������еĹ�������������������Һ�ֳ����ݣ�
b.һ�ݵμӼ���KSCN��Һ������Һ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ��ѡ����ţ���ͬ��������Һδ��Ѫ��ɫ���ƶ�Ӳ�ʲ�����B�й������ʵijɷ�Ϊ ��
��һ����Fe3O4 ��һ����Fe ��ֻ��Fe3O4 ��ֻ��Fe
c.��һ���������������ƣ����� �� ����֤����Һ�д���Fe2+ ��
��3��̽����������������̣���ͼ2���ⶨ��Ӧ��Ӳ�ʲ�����B�й��庬��Ԫ�ص�����������
a.�Լ�b�Ļ�ѧʽ�� ��
b.���㷴Ӧ��Bװ������Ԫ�ص���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʼ��ת���ڸ��������²���ʵ�ֵ��ǣ� ��
A.Al2O3 ![]() NaAlO2��aq��
NaAlO2��aq�� ![]() Al��OH��3
Al��OH��3
B.S ![]() SO3
SO3 ![]() H2SO4
H2SO4
C.����NaCl��aq�� ![]() NaHCO3
NaHCO3 ![]() Na2CO3
Na2CO3
D.MgCl2��aq�� ![]() Mg��OH��2
Mg��OH��2 ![]() MgO
MgO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊʵ��������ȱ��֢������Ŀ�꣬�������Ź涨ʳ�α���ӵ⣬���еĵ��Ե���أ�KIO3����ʽ���ڡ���֪����Һ��IO3����I���ɷ�����Ӧ��IO3-+5I-+6H+�T3I2+3H2O������������Ӧ��������ֽ��һЩ�����г��������ʽ���ʵ�飬֤��ʳ���д���IO3�����ɹ�ѡ�õ������У�������ˮ������ɫʯ����ֽ���۵⻯�ص�����ֽ���ܵ��ۣ���ʳ�ǣ���ʳ�ף��߰ơ���������ʵ��ʱ����ʹ�õ�������
A.�ۢ�B.�٢�C.�ڢܢ�D.�٢ڢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�������̿�MnCO3��[��FeCO3��SiO2��Cu2��OH��2CO3������]Ϊԭ����ȡ�������̣�������ʾ��ͼ���£� 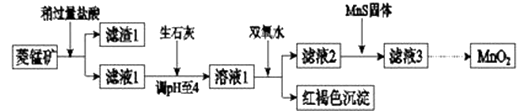
��֪�������������������pH
Mn��OH��2 | Fe��OH��2 | Fe��OH��3 | Cu��OH��2 | |
��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
ע���������ӵ���ʼŨ��Ϊ0.1mol/L���ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ���� �� �����ܽ�MnCO3�Ļ�ѧ����ʽ�� ��
��2������Һ1�м���˫��ˮʱ����Ӧ�����ӷ���ʽ�� ��
��3����Һ2�м����Թ��������ܵ����MnS���Գ�ȥCu2+ �� ��Ӧ�����ӷ���ʽ�� ��
��4����MnCl2ת��ΪMnO2��һ�ַ���������������������������ữ��NaClO3��Һ��MnCl2�������÷�Ӧ�����ӷ���ʽΪ��Mn2++ClO3��+=++ ��
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ��
����������MnO2�ĵ缫��Ӧʽ�� ��
����ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2 �� ����Cl2�IJ����� ��
����������MnCl2��Һ�м���һ������Mn��NO3��2��ĩ������Cl2��������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���밴����Ҫ����գ�
��1����֪��99 ��ʱ��ˮ�����ӻ�����Kw��1.0��10��12�����¶��²��0.1 mol��L��1 Na2A��Һ��pH��6��
��H2A��ˮ��Һ�еĵ��뷽��ʽΪ_________________________��
�������ȡ�pH��1��������H2A��Һ�ֱ�������Zn��Ӧ������������___�����ţ���
A������� B��H2A�� C��һ���� D����ȷ��
�۽�0.1 mol��L��1 H2A��Һ��0.2 mol��L��1��ˮ�������ϣ���ȫ��Ӧ����Һ�и�����Ũ�ȴӴ�С��˳��Ϊ__________________________________��
��2����֪��25 ��ʱ������ƽ�ⳣ����
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ �ⳣ�� | K=1.8��10��5 | K1=4.3��10��7 K2=5.6��10��11 | K=3.2��10��8 |
��ش��������⣺
�����ʵ���Ũ��Ϊ0.1 mol/L�������������ʣ�
a��Na2CO3 b��NaClO c��CH3COONa d��NaHCO3
pH�ɴ�С��˳����________________________________����������
�ڳ�����0.1 mol/L��CH3COOH��Һ��ˮϡ�����У����б���ʽ������һ��������______�����ţ���
A��c(H��) B�� ![]() C��c(H��)��c(OH��) D��
C��c(H��)��c(OH��) D��![]()
��д�������������Һ��ͨ������������̼�����ӷ���ʽ��________��
��25 ��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH��6������Һ��c(CH3COO��)��c(Na��)��_______����ȷ��ֵ����
��25 ��ʱ����a mol/L�Ĵ�����b mol/L�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.�����̪����ɫ����Һ�У�K+��Al3+��Cl����CO32��
B.�������Һ�У�Na+��K+��MnO4����AlO2��
C.![]() =10��13mol?L��1����Һ��Na+��[Ag��NH3��2]+��OH����NO3��
=10��13mol?L��1����Һ��Na+��[Ag��NH3��2]+��OH����NO3��
D.c��I����=0.1mol?L��1����Һ�У�Na+��H+��ClO����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ռ�ʵ���ҡ��칬һ�š��Ĺ���ϵͳ������������ȼ�ϵ�أ�RFC����RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ���أ���ͼΪRFC����ԭ��ʾ��ͼ���й�˵����ȷ���ǣ� �� 
A.ת��0.1mol����ʱ��a�缫����1.12LH2
B.b�缫�Ϸ�����ԭ��Ӧ
C.���Ե������Һ��H+����c�缫
D.d�缫�Ϸ����ĵ缫��Ӧ�ǣ�O2+4H++4e��=2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ǿ�������Һ���ֱ������������������еĸ�һ�֣����һ����ظ���NH ![]() ��Ba2+��Na+��H+��SO
��Ba2+��Na+��H+��SO ![]() ��NO
��NO ![]() ��OH����HCO
��OH����HCO ![]() ������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺 ��C��Һ��������������Һ�У�������������
������������Һ�ֱ���ΪA��B��C��D����������ʵ�飺 ��C��Һ��������������Һ�У�������������
��D��B��Ӧ���ɵ������ܱ�A���գ�
��A��D��Ӧ���ɵ������ܱ�B���գ�
�Իش��������⣺
��1��D�Ļ�ѧʽ�� �� �ж������� ��
��2��д�����༸�����ʵĻ�ѧʽ��A �� B �� C ��
��3��д��ʵ������йط�Ӧ�����ӷ���ʽ ��
��4��д��ʵ������йط�Ӧ�����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com