
【题目】请按下列要求填空:
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___(填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________。
(2)已知:25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.2×10-8 |
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是________________________________(填编号)。
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______(填编号)。
A.c(H+) B. ![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________。
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______(填准确数值)。
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_______________。
【答案】 H2A===2H++A2- C c(NH)>c(A2-)>c(H+)>c(OH-) a>b>d>c B、D ClO-+CO2+H2O===HCO+HClO 9.9×10-7 mol/L ![]()
【解析】(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,c(OH-)= c(H+)=10-6mol/L,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6,则溶液呈中性,Na2A为强酸强碱盐,H2A为强酸。①H2A在水溶液中的电离方程式为H2A=2H++A2-;②体积相等、pH=1的盐酸与H2A溶液n(H+)相等,分别与足量Zn反应产生的氢气一样多,答案选C;③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后为(NH4)2A溶液,(NH4)2A是强酸弱碱盐,水解呈酸性,溶液中各离子浓度从大到小的顺序为:c(NH)>c(A2-)>c(H+)>c(OH-);(2)①由电离平衡常数判断酸性的强弱,酸性越强,其对应盐的水解程度越大,溶液的pH就越大,由表格中的数据可知,酸性CH3COOH>H2CO3>HClO>HCO3-,则水解程度为a>b>d>c,pH由大到小的顺序是a>b>d>c;(2)A.CH3COOH溶液加水稀释过程,促进电离,c(H+)减小,选项A不选;B.稀释过程中电离平衡CH3COOH![]() CH3COO-+H+正向移动,
CH3COO-+H+正向移动, ![]() =
=![]() ,则稀释过程中比值变大,选项B选;C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,Kw不变,选项C不选;D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则
,则稀释过程中比值变大,选项B选;C.稀释过程,促进电离,c(H+)减小,c(OH-)增大,c(H+)c(OH-)=Kw,Kw不变,选项C不选;D.稀释过程,促进电离,c(H+)减小,c(OH-)增大,则![]() 变大,选项D选。答案选BD;③电离常数越大,酸性越强,因此酸性强弱为H2CO3>HClO>HCO3-,故向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O= HCO3-+HClO;④根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L;⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7 mol/L,c(CH3COO-)=c(Na+)=
变大,选项D选。答案选BD;③电离常数越大,酸性越强,因此酸性强弱为H2CO3>HClO>HCO3-,故向次氯酸钠溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O= HCO3-+HClO;④根据电荷守恒得c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7 mol/L;⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,此时c(H+)=c(OH-)=10-7 mol/L,c(CH3COO-)=c(Na+)=![]() mol/L,剩余的c(CH3COOH)=
mol/L,剩余的c(CH3COOH)= ![]() mol/L,则醋酸的电离平衡常数Ka=
mol/L,则醋酸的电离平衡常数Ka=![]() =
= =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A. 所有铵盐都易溶于水,不是所有铵盐中的氮均呈—3价
B. NH4Cl和NaCl的固体混合物可用升华法分离
C. 不是所有铵盐受热分解的产物中均有NH3
D. NH4Cl溶液中加入NaOH浓溶液共热,反应的离子方程式为 NH4++OH- ==NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示温度100℃和200℃平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )

A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:①2BrO ![]() +Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO
+Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO ![]() +5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
+5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )
A.ClO ![]() >BrO
>BrO ![]() >IO
>IO ![]() >Cl2
>Cl2
B.ClO ![]() >BrO
>BrO ![]() >Cl2>IO
>Cl2>IO ![]()
C.BrO ![]() >ClO
>ClO ![]() >Cl2>IO
>Cl2>IO ![]()
D.Cl2>BrO ![]() >ClO
>ClO ![]() >IO
>IO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学实验操作中必须注意安全操作,下列操作或事故处理正确的是( ) ①在点燃易燃性气体前,必须检验气体的纯度
②在稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,并用玻璃棒搅拌
③浓硫酸对皮肤有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸液
④给试管中的液体加热时,液体体积不超过试管容积的三分之一
⑤点燃盛满酒精的酒精灯.
A.仅①②
B.仅①②③
C.仅①②④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下4组实验,如图Ⅰ~Ⅳ所示.
(1)Ⅱ所示的实验,若固体质量相同且稀盐酸足量时,气球鼓起较小的是(填化学式).
(2)Ⅲ、Ⅳ所示的实验均能鉴别这两种物质,相关反应的化学方程式是 . 与Ⅲ相比,IV的优点是(填选项序号).a.Ⅳ比Ⅲ复杂 b.Ⅳ比Ⅲ安全
c.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行
(3)若用Ⅳ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体应该是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应中,都属于取代反应的是( )
A.苯、乙烯分别使溴水褪色
B.溴乙烷分别在NaOH的水溶液、NaOH的醇溶液中反应
C.乙烯、甲苯使酸性KMnO4溶液褪色
D.苯、甲苯在一定条件下与混酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实验装置可以用于实验室制取乙炔.请填空: 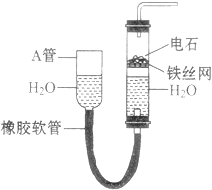
(1)图中A管的作用是 , 制取乙炔的化学反应方程式为 .
(2)乙炔通入酸性KMnO4溶液中,发生反应,可以观察到现象,若通入溴水中,发生反应.
(3)乙炔燃烧的化学方程式为 , 燃烧时的现象为 ,
为了安全,点燃乙炔前应该先 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com