
| A. | m=aVd | B. | a%=(cM/1 0d)% | C. | c=1 000mVM | D. | c=1 000daM |
分析 A.溶质质量m=ρ(溶液)•V(溶液)•w(溶质质量分数);
B.根据c=$\frac{1000ρω}{M}$进行分析该溶质质量分数;
C.根据c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$分析该溶液的物质的量浓度;
D.计算出1L溶液中含有溶质的质量,然后根据n=$\frac{m}{M}$可计算出1L该溶液中含有溶质的物质的量,从而可知该溶液的浓度.
解答 解:A.溶液质量m=d g/mL×VmL×a%=$\frac{aVd}{100}$,故A错误;
B.根据c=$\frac{1000ρω}{M}$可知,ω=a%=$\frac{cM}{1000d}$=(cM/1 0d)%,故B正确;
C.VmL该溶液中含有溶质的物质的量为:$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,该溶液的浓度为:c=$\frac{\frac{m}{M}mol}{V×1{0}^{-3}L}$=$\frac{1000m}{VM}$mol/L,故C错误;
D.1L该溶液中含有溶质的物质的量为:$\frac{1000mL×dg/mL×a%}{Mg/mol}$=$\frac{10da}{M}$mol,则该溶液的浓度为$\frac{10da}{M}$mol/L,故D错误;
故选B.
点评 本题考查了物质的量浓度的计算及判断,题目难度中等,明确物质的量浓度与溶质质量分数的关系为解答关键,注意掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50(b-2a) | B. | (b-2a) | C. | 50(b-a) | D. | 10(b-2a) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体摩尔体积为22.4 L•mol-1 | |
| B. | 1 mol O2的质量是32 g,它所占的体积是22.4 L | |
| C. | 标准状况下,1 mol任何物质的体积均约为22.4 L | |
| D. | 标准状况下,6.02×1023个CO分子的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
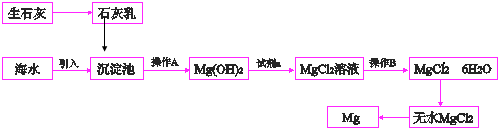
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制操作为:称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| B. | 称量 NaOH固体时,应在托盘天平两盘上各放一张大小相同的纸片 | |
| C. | 若所用NaOH固体中有少量Na2O杂质,则造成所配溶液浓度偏高 | |
| D. | 若用10 mol•L-1NaOH溶液来配制,用量筒量取20 mL NaOH浓溶液倒入烧杯后,应该用同一量筒取一定量蒸馏水倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去AlCl3溶液中的FeCl3杂质的方法:先加入足量浓氨水,过滤,再加入过量盐酸,得到纯净AlCl3溶液 | |
| B. | 可以用金属钠和MgCl2溶液反应置换金属Mg;可以通过化合反应制备Fe(OH)3 | |
| C. | 对某溶液进行焰色反应,火焰呈黄色,则证明该溶液中含有钠盐,可能有钾盐 | |
| D. | 配制氯化铁溶液时,将氯化铁固体溶解在较浓的盐酸中再加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液酸性越强,R 的降解速率越小 | |
| B. | R的起始浓度越小,降解速率越大 | |
| C. | 在0~50 min之间,pH=2和PH=7时R的降解百分率相等 | |
| D. | 在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com