
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
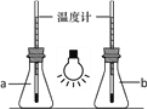
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)聚乙烯塑料常用于食品包装,聚乙烯的结构简式为_________ 。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
【答案】cbab可回收物氧化剂Tl3++3NH3·H2O = Tl(OH)3↓+3NH4+5石灰石(写碳酸钙不扣分)热塑性![]() Fe-2e-= Fe2+SiCl4+O2
Fe-2e-= Fe2+SiCl4+O2 ![]() SiO2+2Cl2
SiO2+2Cl2
【解析】
(1)①葡萄糖不含有钙元素,无法补钙,因此,本题正确答案是:c;
②蛋白质水解生成氨基酸,纤维素、油脂不含氮元素,因此,本题正确答案是:b;
③青霉素是抗生素,胡萝卜素生在人体内合成维生素A,因此,本题正确答案是:a.
(2)①二氧化碳就像温室的玻璃或塑料薄膜那样,具有保温作用,温度高的为二氧化碳,故盛放CO2的锥形瓶为b;
②废旧的塑料可以回收利用,为可回收垃圾,此标志为可回收垃圾标志;
③在废水中加入NaClO溶液,将Ti+转变为Ti3+,则NaClO中氯由+1价降低为-1价,为氧化剂,生成Tl(OH)3的离子方程式:Tl3++3NH3·H2O=Tl(OH)3↓+3NH4+;
(3)①铝、硅、氧、氢氧根分别显+3价、+4价、-2价、-1价,依据化合物中各元素的化合价代数和为0,则有(+3)×2+(+4)×2+(-2)×x+(-1)×4=0,即x=5,故答案为:5;
②生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥。所以在玻璃工业、水泥工业中都用到的原料是石灰石即碳酸钙;聚乙烯为线型结构,故为热塑性塑料,聚乙烯的结构简式为![]() ;
;
③在两种电化学腐蚀中,负极都是金属铁发生失电子的氧化反应,即Fe-2e-=Fe2+;
④SiCl4与O2在高温条件下通过置换反应制得SiO2,由于置换反应的概念是一种单质和一种化合物反应生成另一种单质和另一种化合物,故SiCl4与O2在高温条件下除了生成SiO2还生成氯气,故化学方程式为:SiCl4+O2![]() SiO2+2Cl2。
SiO2+2Cl2。


科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HC1O |
电离平衡常数 | 1.7×10-5 | K1=4.3×10 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HC1O的酸性由强到弱的顺序为______________________。
(2)写出H2CO3的电离方程式:______________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是______________________(填宇母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH)
C. c(H+)·c(OH-) D. 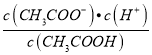
若该溶液升髙温度,上述4种表达式的数据增大的是_________________________。
(4)取0.10mol CH3COOH (冰醋酸)作导电性实验,测得其导电率随加入的水量变化如图所示:比较a、b点的相关性质(填“>”“<”或“=”):
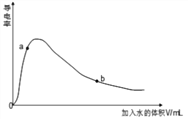
n(H+)∶a_____b;c(CH3COO-)∶a_____b;完全中和时消耗NaOH的物质的量∶a_____b;
(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分別与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同, 则下列说法正确的是__________(填写序号)
①反应所需要的时间B>A ②开始反应时的速率A>B
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一密闭容器中充入一定量CO2,并加入足量铁粉,发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:
FeO(s)+CO(g),测得CO2和CO浓度随时间的变化如图所示:

(1)0~8 min,v(CO2)=__________mol·L-1·min-1。
(2)该反应在恒温恒容的密闭容器中进行,能说明该反应达到化学平衡状态的是_____
A、单位时间内 ,每消耗1molCO2同时生成1molCO
B、容器内气体的压强不再随时间变化
C、容器内气体的密度不再随时间变化
D、容器内气体的平均相对分子质量不再随时间变化
(3)计算该温度下,反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数__________
FeO(s)+CO(g)的平衡常数__________
(4)下列措施中,能够改变平衡时c(CO)/c(CO2)的比值的是________(填序号)。
A、温度 B、铁粉的量(足量) C、压强 D、CO的量
(5)已知:反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
FeO(s)+H2(g)的平衡常数为K2。不同温度时K1、K2的值如下表:
温度/K | K1 | K2 |
973 | 1.47 | 2.38 |
1 173 | 2.15 | 1.67 |
①反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
FeO(s)+H2(g)为______(填“吸热”或“放热”)反应
②根据表中数据,计算反应CO2(g)+H2(g) ![]() CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
CO(g)+H2O(g) 973 K的K______(写出计算式即可,不必计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的最简单的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式为_____,第三周期中除⑩元素以外离子半径最小的是______(填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是_______ (填化学式),元素⑦的简单氢化物的结构式为___________;该氢化物和元素④单质反应的化学方程式为_______________________。
(4)第三周期与②同主族的元素的单质⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的性质决定其用途。下列物质的用途中,利用其物理性质的是( )
A.镁粉用于制作照明弹B.稀有气体用于制作霓虹灯
C.氧气用于医疗急救D.氮气用作充氮包装,保存食品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的铜锌原电池,下列说法正确的是:
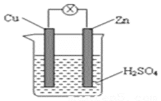
A. 电子由铜电极经导线达到锌片上
B. 随着反应的进行,锌片的质量越来越小
C. 铜片的质量减小,电流表指针发生偏转
D. 该装置实现电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表简化后的一部分,请用标出的元素以及对应的物质回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | ⑩ |
(1)写出由①和③两种元素组成的不带电的两种物质的化学式:________、_______;
(2)①~⑩号元素中最高价氧化物对应的水化物酸性最强的酸的化学式为:_______;
(3)⑩的最高价氧化物对应的水化物与⑧的最高价氧化物在加热的条件下生成盐和水的化学方程式为:___________________________________________________________;
(4)将⑤的单质通入④的常规氢化物中,反应剧烈,对应的化学方程式为:________;
(5)相同条件下⑤⑥⑦⑧四种元素的原子半径由大到小的顺序是:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) ΔH=Q,2 min末达到平衡,生成0.8 mol D。
(1)300 ℃时,该反应的平衡常数表达式为:K=___________________。已知K300 ℃<K350 ℃,则ΔH______0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率______(填“增大”“减小”或“不变”),原因是_____________________________________________________________。
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时加入C、D各4/3mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com