
【题目】下表为元素周期表的一部分,用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的最简单的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式为_____,第三周期中除⑩元素以外离子半径最小的是______(填离子符号)。
(3)②③⑤几种元素最高价氧化物对应的水化物碱性最强的是_______ (填化学式),元素⑦的简单氢化物的结构式为___________;该氢化物和元素④单质反应的化学方程式为_______________________。
(4)第三周期与②同主族的元素的单质⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。
【答案】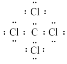 NH3+ HNO3=NH4NO3 Al3+ KOH H—O—H 2F2+2H2O=4HF+O2
NH3+ HNO3=NH4NO3 Al3+ KOH H—O—H 2F2+2H2O=4HF+O2 ![]() Br—>Cl—>F—
Br—>Cl—>F—
【解析】
根据元素在周期表中的位置知,①为N元素、②为K元素、③为Mg元素、④为F元素、⑤为Al元素、⑥为C元素、⑦为O元素、⑧为Cl元素、⑨为Br元素、⑩为Ne元素,结合原子结构和元素周期律分析解答。
根据元素在周期表中位置知,①为N元素、②为K元素、③为Mg元素、④为F元素、⑤为Al元素、⑥为C元素、⑦为O元素、⑧为Cl元素、⑨为Br元素、⑩为Ne元素。
(1)元素⑥与⑧元素组成的化合物为四氯化碳,四氯化碳为共价化合物,其电子式为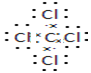 ,故答案为:
,故答案为: ;
;
(2)①的气态氢化物为氨气,其最高价氧化物水化物为硝酸,二者反应生成硝酸铵,反应的化学方程式为:NH3+HNO3=NH4NO3;第三周期中除⑩元素以外离子中,铝离子的电子层最少,且金属离子中铝离子的核电荷数最大,则铝离子是第三周期中离子半径最小,故答案为:NH3+HNO3=NH4NO3;Al3+;
(3)②为K元素、③为Mg元素、⑤为Al元素,K的金属性最强,则最高价氧化物对应的水化物碱性最强的为KOH;元素⑦的氢化物为水,水分子中存在两个氧氢键,其结构式为:H-O-H;元素④单质为氟气,氟气与水反应生成氟化氢和氧气,反应的化学方程式为:2F2+2H2O=4HF+O2,故答案为:KOH;H-O-H;2F2+2H2O=4HF+O2;
(4)与②同主族,第三周期的元素单质为钠,钠在⑦的单质氧气中燃烧生成过氧化钠,过氧化钠为离子化合物,其电子式为:![]() ;④⑧⑨分别为F、Cl、Br元素,非金属性:F>Cl>Br,则元素阴离子的还原性由强到弱顺序为:Br->Cl->F-,故答案为:
;④⑧⑨分别为F、Cl、Br元素,非金属性:F>Cl>Br,则元素阴离子的还原性由强到弱顺序为:Br->Cl->F-,故答案为:![]() ;Br->Cl->F-。
;Br->Cl->F-。


科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是 ( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3+ + 4NH3·H2O == AlO2- + 4NH4+ + 2H2O
B. 酸性溶液中KIO3与KI反应:I- + IO3- + 6H+ == I2 + 3H2O
C. 碳酸钠与次氯酸反应:CO32- + 2HClO = 2ClO- + H2O + CO2↑
D. 碘化亚铁溶液与少量氯气反应:2I- + Cl2 = I2 + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国国标推荐的食品药品中Ca元素含量的测定方法之一:利用Na2C2O4将处理后的样品中的Ca2+沉淀,过滤洗涤,然后将所得CaC2O4固体溶于过量的强酸,最后使用已知浓度的KMnO4溶液通过滴定来测定溶液中Ca2+的含量。针对该实验中的滴定过程,回答以下问题:
(1)KMnO4溶液应该用________(填“酸式”或“碱式”)滴定管盛装。
(2)写出滴定过程中反应的离子方程式:_____________。
(3)滴定终点的颜色变化:溶液由________色变为________色。
(4)以下哪些操作会导致测定的结果偏高________(填字母编号)。
a.装入KMnO4溶液前未润洗滴定管
b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液
d.滴定过程中,振荡时将待测液洒出
(5)某同学对上述实验方法进行了改进并用于测定某品牌的钙片中的钙元素(主要为CaCO3)含量,其实验过程如下:取2.00 g样品加入锥形瓶中,用酸式滴定管向锥形瓶内加入20.00 mL浓度为0.10 mol·L-1的盐酸(盐酸过量),充分反应一段时间,用酒精灯将锥形瓶内液体加热至沸腾,数分钟后,冷却至室温,加入2~3滴酸碱指示剂,用浓度为0.10 mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液8.00 mL。[提示:Ca(OH)2微溶于水,pH较低时不会沉淀]
①为使现象明显、结果准确,滴定过程中的酸碱指示剂应选择_______(填“石蕊”、“甲基橙”或“酚酞”)溶液;
②此2.00 g钙片中CaCO3的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于生命营养物质的说法正确的是
A.糖类都可以发生水解反应B.油脂属于高分子化合物
C.六大营养素都属于有机物D.Cu2+有毒与其能使蛋白质变性有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液 ①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)最大的是________(用序号表示,下同)。
(2)若四种溶液的c(H+)相同,其物质的量浓度最大的是________。
(3)将pH相同的上述四种溶液与Zn反应生成等量氢气,所需时间最短的是_________。
(4)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3 mol·L-1,此温度下醋酸的电离常数Ka=________,(写出计算式,不必计算最终结果)。温度升高,Ka将______(填“变大”、“不变”或“变小”)。
(5)在常温下将pH=11的NaOH溶液a L与pH=2的H2SO4溶液b L混合,若混合后溶液呈中性,则a:b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合理膳食、均衡营养是保证人体健康和生活质量的重要途径。
①人体必需的元素摄入不足会影响人体的正常生理活动。下列做法不能达到目的的是______。
a.补碘——食用加碘盐 b.补铁——使用铁强化酱油 c.补钙——服用葡萄糖
②人体内有8种氨基酸必需通过食物摄入,某品牌饼干含有的下列物质中能转化为氨基酸的是______。
a.纤维素 b.蛋白质 c.油脂
③人类历史上最重要的抗生素是______。
a.青霉素 b.维生素 c.胡萝卜素
(2)构建人与自然的和谐、营造安全的生态环境已成为全人类的共识。
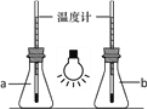
①如图,向两只250mL的锥形瓶中分别充入CO2和空气,用白炽灯泡照射一段时间后,其中a瓶中温度计读数稍低,则盛放CO2的锥形瓶为______(填“a”或“b”)。
②为防止白色污染,废旧的塑料需投入到贴有如图标志的垃圾桶内,该标志表示的是______。

③废水中铊(Tl)具有高毒性,治理时常加入NaClO溶液,将Tl+转变为Tl3+,NaClO作_____(填“氧化剂”或“还原剂”),同时加入适量氨水,将Tl3+转变为难溶物Tl(OH)3,写出生成Tl(OH)3的离子方程式______。
(3)材料是人类社会发展的物质基础,材料科学的发展离不开化学。
①黏土是陶瓷的生产原料,其中江苏宜兴的高岭土是含有杂质较少的高品质黏土,其主要组成可表示为Al2Si2Ox(OH)4,则x=______。
②2016年奥运会在巴西举行,场馆的建设需大量的建筑材料。其中生产水泥、玻璃共同的原料是______(填名称),场馆内的座椅通常用高密度聚乙烯(HDPE)为原料制得,聚乙烯属于______塑料(填“热固性”或“热塑性”)聚乙烯塑料常用于食品包装,聚乙烯的结构简式为_________ 。
③沪通铁路建设正在积极推进,其中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。铁在发生电化学腐蚀时的负极反应方程式为______。
④工业上常用SiCl4与O2在高温条件下通过置换反应制得SiO2,并于2000℃下拉成光纤细丝。该反应的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物K可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示。
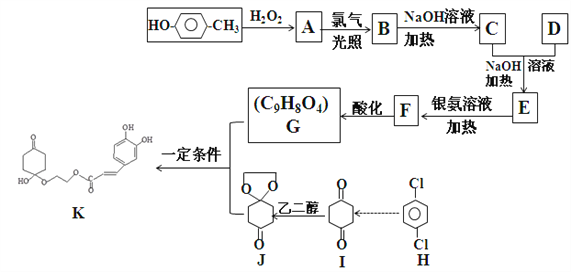
已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基
②醛能发生羟醛缩合反应,再脱水生成不饱和醛:
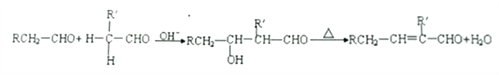
③
请回答:
(1)下列说法不正确的是_________________;
A.化合物A能与FeCl3发生显色反应
B.化合物C能够发生银镜反应
C.I转化为J属于加成反应
D.K与足量NaOH溶液反应时,1molK最多可消耗3molNaOH
(2)化合物D的结构简式为_____________________________________;
(3)E→F的化学方程式为____________________________________________;
(4)G也可以与环氧丙烷(![]() )发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
)发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
(5)写出符合下列条件的A的所有同分异构体的结构简式___________________;
①能与氯化铁溶液发生显色反应
②1H-NMR谱显示分子中苯环上有两种不同化学环境的氢原子
(6)通常采用有机物H为原料合成有机物I,请设计该合成路线_________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)元素⑨的基态原子的价电子排布式为_________________。
(2)这10种元素,其中电负性最大的是________(填元素符号)。
(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.6个原子不在同一平面上 B.属于含有极性键的非极性分子
C.只含有4个sp2-s的δ键和1个P-P的π键 D.该氢化物分子中C原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有________(填序号)。

A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 G. δ键 H.兀键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的D、E、F可能是哪三种元素__________(填元素符号);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的认识正确的是( )
A.第一张元素周期表是美国化学家门捷列夫制成的
B.门捷列夫制定的第一张元素周期表是按照核电荷数由小到大的顺序排列的
C.目前使用的元素周期表是按照原子序数由小到大的顺序排列的
D.同周期元素的原子结构示意图的最外层电子数相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com