
【题目】A、B、C、D、E为短周期元素,在元素周期表中的相对位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数,B原子的质子数和中子数相等。
A | C | |
D | B | E |
请回答下列问题:
(1)E元素位于元素周期表中第________周期第________族。
(2)几种元素中最高价氧化物对应的水化物的酸性最强的是(用化学式表示)____________________。
(3)C元素的原子结构示意图为________,用电子式表示C的氢化物的形成过程:____________。
(4)由元素A、C及氢元素形成的化合物中含有的化学键类型为____________________。
【答案】三 ⅦA HClO4 ![]()
![]() 离子键和共价键
离子键和共价键
【解析】
A、B、C、D、E为短周期元素,A、C两元素原子的核外电子数之和等于B原子的质子数,B原子的质子数和中子数相等,则B是S,在元素周期表中的相对位置如图所示,则A为N,B为S,C为F,D为P,E为Cl,据此分析解答。
(1) E为Cl,硫元素位于元素周期表中第三周期第ⅦA族;
(2)几种元素中,F的非金属性最强,但F没有正价,故没有最高价氧化物对应的水化物,除F外Cl的非金属性最强,非金属性越强,对应最高价氧化物对应水化物的酸性越强,则最高价氧化物对应的水化物的酸性最强的是HClO4;
(3) C为F,其原子结构示意图为: ,气态氢化物为HF,为共价化合物,原子间以共用电子对结合,电子式表示C的气态氢化物的形成过程:
,气态氢化物为HF,为共价化合物,原子间以共用电子对结合,电子式表示C的气态氢化物的形成过程:![]() ;
;
(4)元素A、C及氢元素形成的化合物为NH4F,铵盐属于离子化合物,含有离子键,铵根离子内部N原子和H原子以共价键结合,含有共价键。


科目:高中化学 来源: 题型:
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:
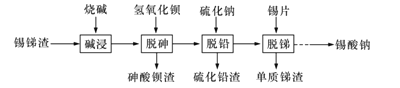
请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
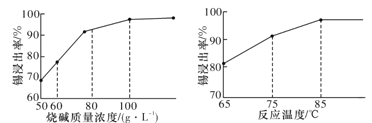
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的键线式如图所示,下列关于该有机物的描述不正确的是
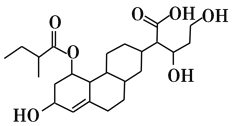
A.含有4种官能团
B.能发生取代、加成、酯化、氧化、还原等反应
C.1mol该物质最多可与3molH2发生加成反应
D.该有机物与Na、NaOH、Na2CO3均能反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(1)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的排布图为_______。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填字母)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)铍、铝晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点(1551K)比铝的熔点(930K)高,原因是____。
(4)氯化铍在气态时存在BeCl2分子(a)和二聚分子(BeCl2)2(b),固态时则具有如下图所示的链状结构(c)。
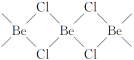
①a属于____(填“极性”或“非极性”)分子。
②二聚分子(BeCl2)2中Be原子的杂化方式相同,且所有原子都在同一平面上。b的结构式为____(标出配位键)。
(5)Al单质的晶体中原子的堆积方式如图乙所示,其晶胞特征如图丙所示,原子之间相互位置关系的平面图如图丁所:
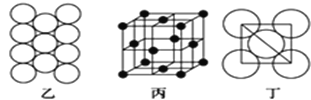
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为___个;Al晶体的密度为_____(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]![]() 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为______________。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
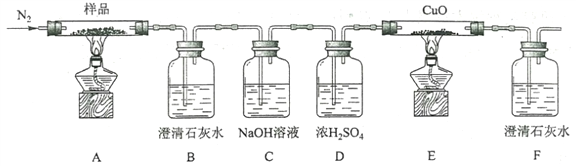
①通入氮气的目的是________________________________________。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有___________、___________。
③为防止倒吸,停止实验时应进行的操作是_____________________________。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:________________。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点。滴定终点的现象是___________________________。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率、化学反应限度的说法中,正确的是( )
A.反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B.用铁片与稀硫酸反应制H2,改用 98%的浓硫酸可加快生成H2的速率
C.反应2SO2(g)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
D.可逆反应达到化学平衡状态时,正、逆反应的速率相等且都为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列卤代烃既能发生消去反应生成烯烃,又能发生水解反应生成醇的是
①![]() ②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
②CH3CH2CH2Br ③CH3F④CH3CH2Br ⑤C(CH3)3CH2Br⑥CH(CH3)2C(CH3)2Br
A. ①③⑤B. ②④⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( )
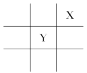
A. X元素的电负性大于YB. X元素的第一电离能大于Y
C. X在周期表中位于第二周期第ⅢA族D. 原子半径Mg>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某条件下,在 2L 密闭容器中发生如下反应:2NO2(g) ![]() 2NO(g)+O2(g)。若反应在三种不同条件下进 行,其中实验 I、II 都在 800℃,实验 III 在 850℃,NO、O2 的起始浓度都为 0 mol/L,NO2 的浓度(mol·L-1) 随时间(min)的变化如图所示,请回答下列问题:
2NO(g)+O2(g)。若反应在三种不同条件下进 行,其中实验 I、II 都在 800℃,实验 III 在 850℃,NO、O2 的起始浓度都为 0 mol/L,NO2 的浓度(mol·L-1) 随时间(min)的变化如图所示,请回答下列问题:
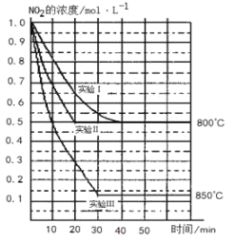
(1)对比实验I、II和III,得出的下列结论中正确的是___________。
A.实验II和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
B.实验II和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验III条件下该反应的平衡常数
D.对比实验I和III可知,该反应正反应是吸热反应
(2)若实验I中NO2的起始浓度改为2.0mol·L-1,其它条件不变,则达到平衡时所需用的时间________40min(填“大于”、“等于”或“小于”),NO2的转化率将____(填“增大”、“减小”或“不变”)。
(3)该反应的平衡常数表达式是___________,若实验I达平衡后,再向密闭容器中通入2mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将___________(填“向左”、“向右”或“不”)移动,达到新平衡时,NO2的物质的量浓度为_________mol·L-1。
(4)若改变外界条件,使该反应的平衡常数数值变大,下列说法正确的是_______。
A. 一定向正反应方向移动 B. 在平衡移动时,正反应速率先增大后减小
C. 一定向逆反应方向移动 D. 在平衡移动时,逆反应速率先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com