
【题目】向一定量FeO、Fe、Fe2O3的混合物中加入200mL1mol/L的盐酸,恰好使混合物完全溶解,并放出1.12L气体(标准状况),所得溶液经检验不含Fe3+。若用足量CO在高温下还原相同质量的此混合物,能得到铁的质量是
A.5.6gB.5.04gC.2.8gD.无法计算
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D. 1 mol迷迭香酸最多能和6 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组设计实验探究SO2的性质。
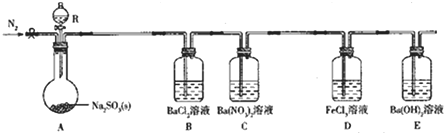
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀。
(1)仪器R的名称是___。
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:___。
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应。“通入一段时间的N2”的目的是___。
(4)探究装置C中通入SO2的量与产物的关系。
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2SO42-+2NO+4H+。
猜想2:通入少量的SO2,则发生反应的离子方程式为___。
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
实验步骤 | 实验现象及结论 |
取少量C中反应后溶液于试管中,___ | ___ |
(5)下列可检验装置D反应后溶液中是否有Fe2+的最佳试剂是___(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH___7(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是
A.FeCl3溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.将饱和FeCl3溶液滴入沸水制得Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.向Ba(OH)2溶液中滴加NaHSO4溶液使Ba2+刚好沉淀完全:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、Cl-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断错误的是
A.沉淀甲是H2SiO3
B.干燥的气体甲可能是纯净物
C.溶液X中一定存在K+、AlO2-和SiO32-
D.取溶液甲加入硝酸酸化,再滴加AgNO3溶液,若有白色沉淀,则溶液X中含有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
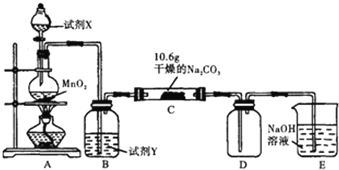
(1)装置A中发生反应的化学方程式是___。
(2)试剂Y是___;作用是___。
(3)已知:通入一定量的氯气后,测得D中有一种常温下为黄红色的气体,其为含氯的氧化物.可以确定的是C中含有氯元素的盐只有一种,且含有NaHCO3,现对C中反应后固体的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和物质W;
假设2:存在三种成分:NaHCO3、Na2CO3和物质W。
则上述假设中物质W为___(填化学式)。
设计方案,进行实验。请填写相应的实验步骤以及预期现象和结论。
限选实验试剂:稀H2SO4、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加___ | ①若无明显现象,证明固体中不含___ ②若出现___(填现象和结论) |
步骤3:向B试管中滴加___ | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立 |
(4)若假设1成立,已知C中有0.1molCl2参加反应,推知C中反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
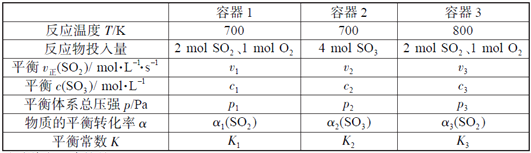
下列说法正确的是
A. v1< v2,c2< 2c1 B. K1> K3,p2> 2p3
C. v1< v3,α1(SO2 ) >α3(SO2 ) D. c2> 2c3,α2(SO3 )+α3(SO2 )<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家实施“青山绿水工程”,大力研究脱硝和脱硫技术。
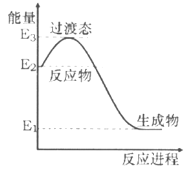
(1)H2在催化剂作用下可将NO还原为N2。下图是该反应生成1 mol水蒸气的能量变化示意图。写出该反应的热化学方程式____________(△H可用E1、E2、E3表示)。
(2)我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2=H2O2+S↓
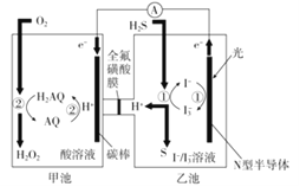
①装置中H+向________池迁移。
②乙池溶液中发生反应的离子方程式:____________
(3)2NO(g)+O2(g)![]() 2NO2(g)的反应历程如下:
2NO2(g)的反应历程如下:
反应I:2NO(g)![]() N2O2(g)(快);
N2O2(g)(快);![]() <0 v1正=k1正 c2(NO) 、v1逆=k1逆 c(N2O2)
<0 v1正=k1正 c2(NO) 、v1逆=k1逆 c(N2O2)
反应Ⅱ:N2O2(g)+O2(g)![]() 2NO2(g)(慢)
2NO2(g)(慢) ![]() 2<0 v2正=k2正 c(N2O2)c(O2) v2逆=k2逆 c2(NO2);
2<0 v2正=k2正 c(N2O2)c(O2) v2逆=k2逆 c2(NO2);
在一定条件下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,平衡常数=___________(用含K1正、K1逆、K2正、K2逆的代数式表示)。
2NO2(g)达到平衡状态,平衡常数=___________(用含K1正、K1逆、K2正、K2逆的代数式表示)。
(4)废水处理时,通H2S(或加S2-)能使某些金属离子生成极难溶的硫化物而除去。25°℃,某废液中c(Mn2+)=0.02mol·L-1,调节废液的pH使Mn2+开始沉淀为MnS时,废液中c(H2S)=0.1mol·L-1,此时pH约为____。(已知:Ksp(MnS)=5.0×10-14,H2S的电离常数:K1=1.5×10-7,K2=6.0×10-15,1g6=0.8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.已知0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液
CH3COO-+H+,加少量烧碱溶液可使溶液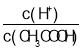 增大
增大
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
D.0.1 mol·L-1的醋酸加水稀释后,溶液中所有离子的浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com