
【题目】下列说法中正确的是( )
A.已知0.1 mol·L-1的CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液
CH3COO-+H+,加少量烧碱溶液可使溶液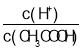 增大
增大
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O![]() H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.室温下向10 mL pH=3的醋酸溶液中加水稀释后,溶液中![]() 不变
不变
D.0.1 mol·L-1的醋酸加水稀释后,溶液中所有离子的浓度均减小
科目:高中化学 来源: 题型:
【题目】向一定量FeO、Fe、Fe2O3的混合物中加入200mL1mol/L的盐酸,恰好使混合物完全溶解,并放出1.12L气体(标准状况),所得溶液经检验不含Fe3+。若用足量CO在高温下还原相同质量的此混合物,能得到铁的质量是
A.5.6gB.5.04gC.2.8gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示的转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
![]()
A.X可能为Al或Cl2
B.Y一定为NaOH(aq)
C.N一定是HCl(aq)
D.Q、Z中的一种必为Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:
①KCl ②CH4 ③NH4NO3 ④I2 ⑤Na2O2 ⑥HClO4 ⑦N2 ⑧CO ⑨SO2 ⑩金刚石 CH3CH2OH MgO MgCl2 KOH HCl Al2O3
请回答下列问题。
(1)两性氧化物是___(填序号),其电子式为___。
(2)最简单的有机化合物是___(填序号),用电子式表示其形成过程:___。
(3)属于共价化合物的是___(填序号),含有共价键的离子化合物是___(填序号)。
(4)由两种元素组成,且含有离子键和共价键的化合物为___(填序号),这两种元素的单质反应生成该化合物的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花汁中提取的一种有机物HIn,可做酸、碱指示剂,在水溶液中存在电离平衡:HIn(红色)![]() H+ + In-(黄色)△H>0对上述平衡解释不正确的是
H+ + In-(黄色)△H>0对上述平衡解释不正确的是
A.升高温度平衡向正方向移动
B.加入盐酸后平衡向逆方向移动,溶液显红色
C.加入NaOH溶液后平衡向正方向移动,溶液显黄色
D.加入NaHSO4溶液后平衡向正方向移动,溶液显黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富硼渣中含有镁硼酸盐(2MgO·B2O3)、镁硅酸盐(2MgO·SiO2)及少量Al2O3、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(H3BO3)晶体的一种工艺流程如下:

已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1mol/L)
Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
(1)上述流程中能加快反应速率的措施有______、_______等。
(2)酸浸时发生反应:2MgO·SiO2 + 2H2SO4=2MgSO4 + SiO2 + 2H2O,2MgO·B2O3+ 2H2SO4 + H2O=2H3BO3 + 2MgSO4。
①上述反应体现出酸性强弱:H2SO4______H3BO3(填“>”或“<”)。
② 酸浸时,富硼渣中所含Al2O3和FeO也同时溶解,写出相关反应的离子方程式:______、______。
③ 已知硼酸与过量NaOH溶液发生的中和反应为:H3BO3 + OH- B(OH)4-。下列关于硼酸的说法正确的是__(填序号)。
a. 硼酸是一元酸
b. 向NaHCO3固体中滴加饱和硼酸溶液,有气泡产生
c. 硼酸的电离方程式可表示为:H3BO3 + H2O![]() B(OH)4-+H+
B(OH)4-+H+
(3)检验褐色浸出液中的杂质离子:取少量浸出液,______(填操作和现象),证明溶液中含有Fe2+。
(4)除去浸出液中的杂质离子: 用MgO调节溶液的pH至______以上,使杂质离子转化为______(填化学式)沉淀,过滤。
(5)获取晶体:ⅰ.浓缩滤液,使MgSO4和H3BO3接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合下图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,______(将方法补充完整)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加徳罗常数的值,下列有关叙述正确的为
A.1 mol铁粉在1 mol氧气中充分燃烧,失去的电子数为3NA
B.标况下,3.36 LSO3含有的电子数为6NA
C.4.2 g乙烯和丙烯混合气中含有的极性键数目为0.6NA
D.1L 1mol/L的葡萄糖溶液中,含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学对人类的一项重大贡献。
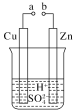
(1)某兴趣小组为研究原电池原理,设计如图装置。
①a和b不连接时,烧杯中发生反应的离子方程式是__________________。
②a和b用导线连接,Cu极为原电池__极(填“正”或“负”),该电极反应式是_,溶液中的H+移向_____(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子,则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:
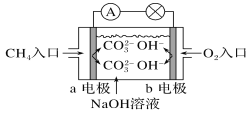
①电池的负极是_______(填“a”或“b”)电极,该极的电极反应式为: ________
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )

A. 途径②增大O2浓度可提高SO2转化率
B. 含l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C. 途径②中SO2和SO3均属于酸性氧化物
D. 若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2(g)为放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com