
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是
A. AgCl不溶于水,不能转化为AgI
B. 在含有浓度均为0.001mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C. AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D. 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
【答案】A
【解析】
试题A、AgI比AgCl更难溶,反应向着更难溶的方向进行,因此AgCl能转化成AgI,故说法错误;B、Ksp(AgI)=c(Ag+)×c(I-),c(Ag+)=Ksp(AgI)/c(I-)=10-16/0.001mol·L-1=10-13mol·L-1,Ksp(AgCl)=c(Ag+)×c(Cl-),c(Ag+)=Ksp(AgCl)/c(Cl-)=1.8×10-10/0.001mol·L-1=1.8×10-7mol·L-1,因此AgI先沉淀,故说法正确;C、根据选项A的分析,故说法正确;D、AgCl溶液中c2(Ag+)=Ksp(AgCl),c(Ag+)=![]() ×10-5mol·L-1,c(I-)=Ksp/c(Ag+)=
×10-5mol·L-1,c(I-)=Ksp/c(Ag+)=![]() ×10-11mol·L-1,故说法正确。
×10-11mol·L-1,故说法正确。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(I)某温度下,气体X和Y在体积为2L的密闭容器中反应,生成气体Z。经测定各物质的物质的量随时间变化如下图所示,经10s达到化学平衡状态,请回答下列问题。
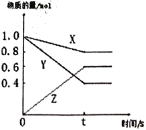
(1)写出该反应的化学反应方程式____________________________________。
(2)该温度下此反应的平衡常数______________________。
(Ⅱ).已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0请回答下列问题:
P(g)+Q(g) ΔH>0请回答下列问题:
(3)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1,c(N)=2.4 mol·L-1;达到平衡后,M的转化率为60%,此时N的转化率为___________;
(4)若反应温度升高,M的转化率_______(填“增大”“减小”或“不变”) ;
(5)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=a mol·L-1;达到平衡后,c(P)=2 mol·L-1,a=_________;
(6)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定试样Fe2O3、Cu、Fe混合物中铜的质量分数,某同学取质量为ag的试样进行下列实验,所得气体数据在标准状况下测得,所涉及的过程如下:

注:已知:Fe3+、Fe2+、Cu2+转化为相应的氢氧化物,开始沉淀和沉淀完全时的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Cu2+ |
开始沉淀PH | 2.5 | 7.0 | 4.7 |
完全沉淀PH | 3.7 | 9.0 | 6.7 |
下列说法不正确的是
A. 气体B为氢气
B. 溶液A中所含的阳离子可能是H+ 、 Fe3+ 、 Fe2+、 Cu2+
C. 加入过氧化氢溶液时发生的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D. 若沉淀E经洗涤、烘干、灼烧后得到固体mg,则试样中Cu的质量分数=(a-0.56)/a×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
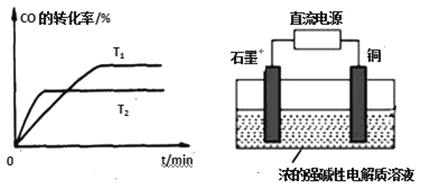
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验 Cl2的性质。下列说法正确的是( )

A.Ⅰ图:若 MnO2 过量,则浓盐酸可全部消耗完
B.Ⅱ图:证明新制氯水具有酸性和漂白性
C.Ⅲ图:产生了棕黄色的雾
D.Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸和二氧化硫的性质,设计了如下图所示的装置进行实验(夹持装置已省略):

请回答:
(1)用“可抽动铜丝”代替“直接投入铜片”的优点是_____。
(2)说明SO2气体产生的实验现象是_____。装置⑤的作用是_____。
(3)为了验证SO2是酸性氧化物,③中可选择的试剂是_____。
A.澄清石灰水 B.饱和食盐水 C.碘水 D.品红溶液
(4)下列说法正确的是_____。
A.实验开始后,②和④中溶液均褪色,两者均可证明SO2具有漂白性
B.反应后,将①试管中的白色固体加入水中,溶液呈蓝色
C.先向装置中加入试剂(药品),再进行气密性检查
D.⑤中的NaOH溶液可用Na2CO3溶液代替
(5)若将抽动的铜丝换成炭块进行反应,写出反应的化学方程式_____;该反应体现浓硫酸的_____(选填“脱水性”“吸水性”“强氧化性”“酸性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A、B两个装置中的烧杯分别盛有足量的CuCl2溶液。

(1)A、B、C三个装置中属于原电池的是________(填标号,下同),属于电解池的是_____________
(2)A池中Zn是_____极,电极反应式为________;Cu是______极,电极反应式为______________,A中总反应的方程式为________________________。
(3)B池中总反应的方程式为________________。
(4)C池中Zn是____极,电极反应式为_____;Cu是______极,电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
A. a=b B. 混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
C. 混合溶液的pH=7 D. 混合溶液中,c(H+) =![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com