
【题目】磷的价电子排布为 3s23p3,P 与 Cl 形成的化合物有 PCl3、PCl5,对此判断正确的是
A.磷原子最外层有三个未成对电子,故只能结合三个氯原子形成 PCl3
B.PCl3 分子是平面结构
C.PCl5 分子中的 P—Cl 键都是 π 键
D.磷原子最外层有三个未成对电子,但是能形成 PCl5,说明传统的价键理论存在缺陷
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,反应:A(g)+B(g) ![]() C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )
A.A的浓度一定比原平衡小
B.A的转化率增大
C.C的体积分数一定大于原平衡C的体积分数
D.B的转化率一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以进行如图所示的转化。
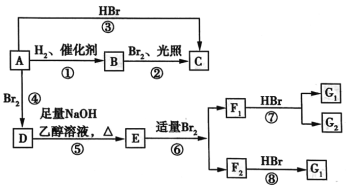
已知:D是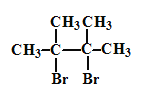 。
。
请填空:
(1)A的结构简式是________,其名称为________。
(2)图中属于取代反应的是________(填数字代号)。
(3)图中①、③、⑥属于________反应。
(4)G1的结构简式是________。
(5)写出由D→E的化学方程式:______;写出由E→F2的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
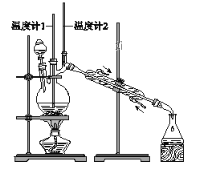
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
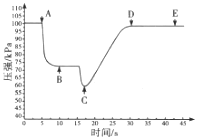
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理![]() 如图所示
如图所示![]() ,并测定电离平衡常数Kb.
,并测定电离平衡常数Kb.
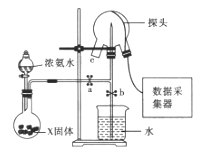
(1)实验室可用浓氨水和X固体制取![]() ,X固体可以是_________;
,X固体可以是_________;
A.生石灰 ![]() 无水氯化钙
无水氯化钙 ![]() 五氧化二磷
五氧化二磷 ![]() 碱石灰
碱石灰
(2)检验三颈瓶集满![]() 的方法是________________________________________。
的方法是________________________________________。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,______________,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图所示。图中 ___点时喷泉最剧烈。
(4)从三颈瓶中用 ____________![]() 填仪器名称
填仪器名称![]() 量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
查看答案和解析>>
科目:高中化学 来源: 题型:
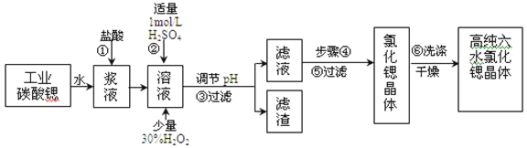
【题目】工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl26H2O),其过程为:
已知:I.有关氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
II.SrCl26H2O晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
请回答:
⑴在步骤②中加入少量的30% H2O2,反应的离子方程式_______________。
⑵在步骤③中,需要将溶液的pH由1调节至3.7以上,适宜用选的试剂为__________。过滤所得滤渣的主要成分是_______________。
⑶关于上述流程中的步骤④、⑤、⑥的说法,正确的是____________。
A. 步骤④包括用60℃的热水浴加热蒸发到溶液表面出现晶膜、冷却结晶
B. 可以通过降低结晶速率的方法来得到较大颗粒的SrCl26H2O晶体
C. 某溶液降温后若无晶体析出,可用玻璃棒搅动或轻轻摩擦容器壁
D. 步骤⑤为趁热过滤,步骤⑥的洗涤剂为饱和![]() 溶液
溶液
⑷工业上采用减压烘干或者用50~60℃的热风吹干SrCl26H2O晶体的原因是______________。
⑸为了测定所得SrCl26H2O晶体样品的纯度,设计了如下方案:称取1.40g样品溶解于适量水中,向其中加入含AgNO3 2.38g的硝酸银溶液(溶液中除Cl-外,不含其它与Ag+反应生成沉淀的离子),Cl-即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2000 mol·L-1的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定SrCl26H2O晶体样品的纯度。用去上述浓度的NH4SCN溶液20.00mL,则原SrCl26H2O晶体的纯度为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
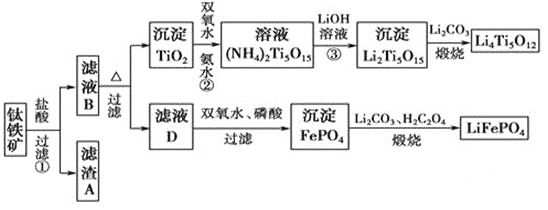
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。
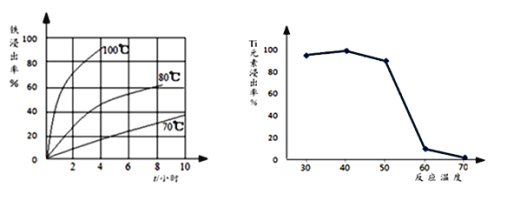
⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中充入1 molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应H2(g)+I2(g) ![]() 2HI(g),下列说法正确的是
2HI(g),下列说法正确的是
A. 保持容器容积不变,向其中加入1molH2,化学反应速率不变
B. 保持容器容积不变,向其中加入1molAr,化学反应速率增大
C. 保持容器内气体压强不变,向其中加入1molAr,化学反应速率不变
D. 保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),化学反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯,下列说法正确的个数是( )
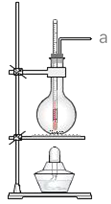
①浓硫酸只作催化剂
②在反应容器中放入几片碎瓷片防止混合液暴沸
③反应温度缓慢上升至170℃
④用排水法或向下排气法收集乙烯
⑤圆底烧瓶中装的是4mL乙醇和12mL3mol/LH2SO4混合液
⑥温度计应插入反应溶液液面下,以便控制温度
⑦反应完毕后先熄灭酒精灯,再从水中取出导管
⑧该反应类型属于取代反应
⑨若a口出来的气体使溴水褪色,说明有乙烯生成
A.1B.2C.3D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com