
【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),△H=-xkJ/mol(x>0),其他相关数据如表:
CO(NH2)2(s)+H2O(g),△H=-xkJ/mol(x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
则表中z(用x、a、b、d表示)的大小为___。
(2)120℃时,在2L密闭反应容器中充入3molCO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应60s内CO2的平均反应速率为___。
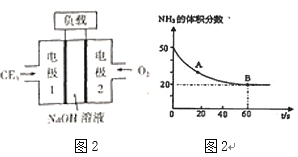
下列能使正反应的化学反应速率加快的措施有___。
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。
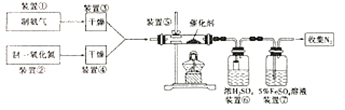


(3)写出装置⑤中反应的化学方程式___;
(4)装置①和装置②如图4,仪器A中盛放的药品名称为___。装置②中,先在试管中加入2-3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是___。
(5)装置⑥中,小段玻璃管的作用是___;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是___。
【答案】x-d+b+2a 0.0047mol/(Ls) ②③ 4NH3+6NO![]() 5N2+6H2O 浓氨水 产生CO2,排出装置中的空气,防止NO被氧化 防倒吸 溶液变浑浊
5N2+6H2O 浓氨水 产生CO2,排出装置中的空气,防止NO被氧化 防倒吸 溶液变浑浊
【解析】
(1) △H=反应物的总键能-生成物的总键能。
(2)设参加反应的CO2物质的量为x,利用三段式建立关系式,求出x,从而可求出该反应60s内CO2的平均反应速率。
①尿素呈固态,及时分离出尿素,对反应没有影响;
②升高温度,可加快反应速率;
③向密闭定容容器中再充入CO2,增大反应物浓度,加快反应速率;
④降低温度,减慢反应速率。
(3)装置⑤中,NH3、NO在催化剂作用下反应,生成N2和水。
(4)装置①利用浓氨水滴入生石灰中制取氨气。装置②中,先在试管中加入2-3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,由于NO易与空气中的O2反应,所以加入石灰石,排尽装置内的空气。
(5)装置⑥用于干燥气体,但NH3易被浓硫酸吸收产生倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,NH3会与FeSO4发生反应。
(1) △H=反应物的总键能-生成物的总键能,即-x=(2a+b)-(z+d),从而得出z=x-d+b+2a。答案为:x-d+b+2a;
(2)设参加反应的CO2物质的量为x,利用三段式建立关系式:
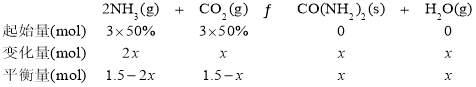
![]() ,x=
,x=![]() mol,该反应60s内CO2的平均反应速率为
mol,该反应60s内CO2的平均反应速率为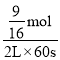 = 0.0047mol/(Ls)。答案为:0.0047mol/(Ls);
= 0.0047mol/(Ls)。答案为:0.0047mol/(Ls);
①尿素呈固态,及时分离出尿素,对反应没有影响,①不合题意;
②升高温度,可加快反应速率,②符合题意;
③向密闭定容容器中再充入CO2,增大反应物浓度,加快反应速率,③符合题意;
④降低温度,减慢反应速率,④不合题意;
故选②③。答案为:②③;
(3) 装置⑤中,NH3、NO在催化剂作用下反应,生成N2和水,反应的化学方程式4NH3+6NO![]() 5N2+6H2O。答案为:4NH3+6NO
5N2+6H2O。答案为:4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(4) 装置①利用浓氨水滴入生石灰中制取氨气,仪器A中盛放的药品名称为浓氨水。
装置②中,先在试管中加入2-3粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,由于NO易与空气中的O2反应,所以加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化。答案:浓氨水;产生CO2,排出装置中的空气,防止NO被氧化;
(5)装置⑥用于干燥气体,但NH3易被浓硫酸吸收而产生负压,所以小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,NH3会与FeSO4发生反应,可观察到的实验现象是溶液变浑浊。答案为:防倒吸;溶液变浑浊。


科目:高中化学 来源: 题型:
【题目】某科研小组在FeO催化下,利用回收资源CO2进行科研。工艺如下所示。
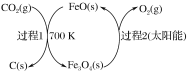
(1)完成有太阳能参与的反应式是______________。
(2)过程1改为电解, FeO电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语叙述中不正确的是( )
A.NH4H的电子式为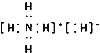 ,NH4H中的H-半径比锂离子半径大
,NH4H中的H-半径比锂离子半径大
B.NH4H晶体既有共价键又有离子键
C.N2的电子式:![]() ,二氧化碳分子的结构式为O-C-O
,二氧化碳分子的结构式为O-C-O
D.镁-24原子表示为![]() Mg,S原子的结构示意图
Mg,S原子的结构示意图![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示分别是某课外活动小组设计的制取氨气并用氨气进行喷泉实验的三组装置,回答下列问题:
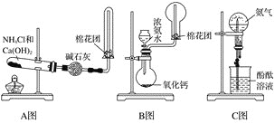
(1)用A图所示的装置可制备干燥的NH3:
①反应的化学方程式为___。装置中收集NH3的试管口放置棉花团的作用是___。
②干燥管中干燥剂能否改用无水CaCl2?__(填“能”或“不能”)。
(2)用B图所示的装置可快速制取较大量NH3:
①用化学方程式表示浓氨水滴入CaO中有大量NH3逸出的过程:___。
②检验NH3是否收集满的实验方法是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL含HCl的AlCl3溶液中逐滴加入0.1mol·L-1的NaOH溶液,加入NaOH溶液的体积V(mL)与产生Al(OH)3沉淀的物质的量n(mol)的关系如图:

试计算:(请写出运算过程)
(1)原溶液中HCl的物质的量浓度。____________
(2)原溶液中AlCl3的物质的量浓度。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2。某校化学研究小组利用下图实验装置检验产物中的H2和CO(设气体均被充分吸收)。下列有关说法正确的是

A. ②、③、⑤中依次盛装澄清石灰水、浓硫酸和氢氧化钠溶液
B. 为了实验安全性,应先点燃①处酒精灯,后点燃④处酒精灯
C. 当黑色氧化铜变红色,即可证明产物中一定含有H2 和CO
D. 若用碱石灰替换无水硫酸铜,也可达到检验H2 和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是

A. 氢氧化钠溶液的作用是吸收多余的SO2气体
B. 反应管内产生的红色粉末可能是Fe2O3
C. BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3
D. 反应管内得到的氧化产物和还原产物物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示实验装置探究铜丝与过量浓硫酸的反应。
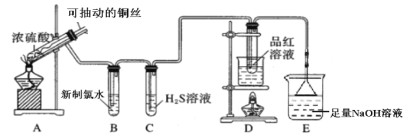
(1)写出A中发生反应的化学方程式__________。在此反应中,浓硫酸表现出来的性质有__________。(填字母序号)
A.强氧化性 B.酸性 C.吸水性 D.脱水性
(2)一段时间后,观察到B中溶液黄绿色褪去,B中反应的化学方程式为__________。C中的实验现象为__________。
(3)D中的实验现象是__________,一段时间后,点燃D处酒精灯,可以观察到__________。
(4)E装置中NaOH溶液的作用是__________。
(5)研究小组认为可以用H2O2溶液来验证E中溶液含有SO32-,进行了实验i。
实验序号 | 操作 | 现象 |
i | a. 取少量E中溶液,向其中加入适量H2O2溶液,振荡,观察。 | 无明显现象 |
b. 然后滴加__________,振荡,观察。 | 无明显现象 | |
c. 再滴加__________,振荡,观察。 | 白色沉淀 |
通过实验i可证明E中溶液含有SO32-,写出操作b、c中滴加的试剂是__________、__________。
(6)研究小组反思实验方案i不够严谨,设计了对比实验,证明了E中含有SO32-。该对比实验方案是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com