
【题目】认真观察图中装置,回答下列问题:
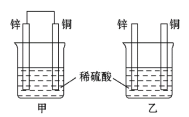
(1)下列说法中正确的是_________(填序号)。
a.甲中铜片质量减少 b.乙中锌片质量减少
c.乙中铜片上没有明显变化 d.甲装置为原电池,乙装置为电解池
(2)同等条件下,两烧杯中产生气泡的速率:甲______(填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为_______(正极或负极),写出铜极的反应电极方程式_______。
(4)当甲中产生2.24 L(标准状况)气体时,理论上通过导线的电子数目为_______mol。
【答案】bc > 负 2H++2e-=H2↑ 0.2
【解析】
(1)根据原电池构成条件及反应原理分析解答;
(2)原电池反应可以加快反应速率;
(3)活动性强的电极为负极,负极失去电子,发生氧化反应;活动性弱的电极为正极,正极上溶液中的H+得到电子被还原产生H2;
(4)根据同一闭合回路中电子转移数目相等,结合物质的量的有关计算公式计算。
(1)a.甲构成了原电池,Cu活动性比Zn弱,为正极,正极上溶液中的H+得到电子被还原产生H2,Cu电极本身不参加反应,因此甲中铜片质量不变,a错误;
b.在金属活动性顺序表中Zn位于H的前边,可以与酸发生置换反应而被氧化,因此锌的质量会不断减少,b正确;
c.Cu的活动性比H弱,因此不能与酸发生反应,所以乙中铜片上没有明显变化,c正确;
d. 甲装置具备原电池构成条件,形成了原电池,乙装置没有形成闭合回路,也没有电源,因此既没有构成原电池,也没有形成电解池,d错误;
故合理选项是bc;
(2)甲装置构成了原电池,Zn为负极,失去电子,被氧化变为Zn2+;Cu活动性弱,为原电池的正极,正极上溶液中的的H+得到电子被还原产生H2,原电池反应加快了放出氢气的速率,而乙装置没有形成原电池,因此同等条件下,两烧杯中产生气泡的速率:甲>乙;
(3)甲烧杯中形成原电池,由于金属活动性Zn>Cu,锌电极为负极,失去电子被氧化;铜为正极,正极上溶液中的的H+得到电子被还原产生H2,电极反应式为:2H++2e-=H2↑;
(4)2.24 L标准状况下的氢气的物质的量n(H2)=![]() =0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。
=0.1 mol,根据电极反应式2H++2e-=H2↑可知:每反应产生1 mol H2,转移2 mol电子,则产生0.1 mol H2时转移电子的物质的量是0.2 mol。


科目:高中化学 来源: 题型:
【题目】已知煤的部分结构模型如图所示:

(1)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的________等气体物质,造成严重的大气污染。
(2)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物3.4-苯并芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。下列物质中适宜作固硫剂的有________(填字母)。
A.氯化钙 B.氧化钙 C.硫酸钙 D.氢氧化钙
(3)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程:_____________________________________________________________。
(4)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有________、________、________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,用NaOH调节0.10mol/LH2C2O4溶液的pH,假设不同pH下均有c(H2C2O4)+c(HC2O4—)+c(C2O42-)=0.10mol/L。使用数字传感器测得溶液中各含碳微粒的物质的量浓度随pH的变化曲线如下图。下列有关分析正确的是

A. 曲线a代表H2C2O4浓度随pH的变化
B. pH从4到6时主要发生的反应离子方程式为2OH-+H2C2O4====2H2O+C2O42-
C. 在曲线a、c交界点有:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
D. 当溶液pH=7时:c(Na+)>c(C2O42-)>c(HC2O4-)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g) ![]() 2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
2HI(g).已知起始时加入1molH2和2molI2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
A. 2molH2(g)和1molI2(g) B. 3molHI(g)
C. 2molH2(g)和2molI2(g) D. 1molI2(g)和2molHI(g)[来科
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型(如图),请回答:
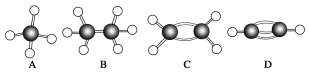
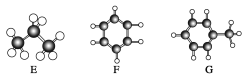
(1)常温下含碳量最高的液态烃是__________(填字母)。
(2)能使酸性KMnO4褪色的有______种(填数字)。
(3)一卤代物种类最多的是________(填字母)。
(4)写出实验室制取D的化学方程式_________。
(5)写出G与浓硝酸反应生成烈性炸药的化学方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生想通过测定反应过程中所放出的热量来计算中和热。他将50 mL0.5 mol/L的盐酸与50 mL0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
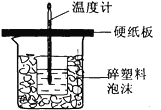
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是____。
(2)实验中改用20 mL0.50 mol/L的盐酸跟20 mL0.55 mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量____(填“相等”或“不相等”);所求中和热的数值会___(填“相等”“偏大”或“偏小”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com