
【题目】工业生产硫酸时,其中之一的反应是2SO2+O2![]() 2SO3,下列说法错误的是
2SO3,下列说法错误的是
A. 使用催化剂能显著增大反应速率
B. 压缩体积可提高反应速率
C. 达到化学平衡时,反应停止
D. 增大SO2的浓度可提高反应速率
【答案】C
【解析】
升高温度、增大压强、增大反应物浓度和使用催化剂等,可提高反应速率;在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。
A项、使用催化剂,降低反应活化能,活化分子百分数增加,有效碰撞次数增加,反应速率增大,故A正确;
B项、压缩体积,容器中压强增大,单位体积活化分子数目增加,有效碰撞次数增加,反应速率增大,故B正确;
C项、达到化学平衡时,正、逆反应速率相等,反应没有停止,反应速率不为零,故C错误;
D项、增大SO2的浓度,单位体积活化分子数目增加,有效碰撞次数增加,反应速率增大,故D正确。
故选C。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B. 常温下,浓度均为0.1 mol·L-1的①醋酸、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C. 将相同体积的pH=3的硫酸和pH=11的NaOH溶液混合,所得溶液一定为中性
D. 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A. ①②③⑤ B. ③⑥ C. ③ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 碳酸钙跟醋酸反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫酸铝溶液中加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
C. 向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D. 碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO![]() =BaCO3↓+CO
=BaCO3↓+CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4![]() N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
A.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe+H2SO4=FeSO4+H2↑的能量变化趋势,如图所示:
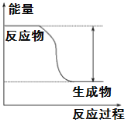
①该反应为________反应(填“吸热”或“放热”)。
②若要使该反应的反应速率加快,下列措施可行的是________(填字母)。
A.改稀硫酸为98%的浓硫酸 B.升高温度 C.改铁片为铁粉
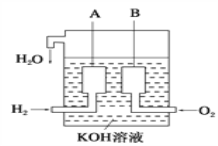
(2)美国阿波罗宇宙飞船上使用了一种新型燃料电池,其构造如图所示,A、B两个电极均由多孔的碳块组成,该电池的负极反应式为:_______________________________。
(3)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。回答下列问题:
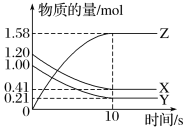
①从反应开始到10 s时,v(Z)=______________。
②反应的化学方程式为______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是( )

A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B.0℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) 2SO3(g) ΔH=-2akJ·mol-l
C.该反应中,反应物的总键能小于生成物的总键能
D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
A. 曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系
B. 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去)。
![]()
(1)若A是一种黄色单质固体,则B→C的化学方程式为____。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为____,试用化学方程式表示该物质与水的反应____。将C长期露置于空气中,最后将变成物质D,D的化学式为____。
(3)若C是红棕色气体,A是一种能使湿润的红色石蕊试纸变蓝的气体。请结合所学知识,写出实验室制取A的化学方程式____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com