
| 催化剂 |
| 加热 |
| 温度℃ | 450 | 500 | 550 | 600 |
| SO2的转化率% | 97.5 | 95.8 | 90.50 | 80.0 |
| [0.32]2 |
| [0.08]2×0.84 |
| 400 |
| 21 |
| 400 |
| 21 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
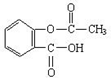 化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.
化学是造福人类的科学,在人体保健、医疗卫生等方面作出了重大的贡献.请你用所学的化学知识解答有关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH2=CH2+HCl→CH3CH2Cl | |||
B、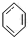 +HO-NO2 +HO-NO2
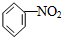 +H2O +H2O | |||
C、CH4+Cl2
| |||
D、2 CH3CH2OH+O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
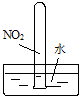 | 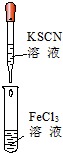 | 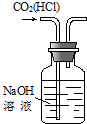 | 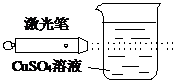 |
| ① | ② | ③ | ④ |
| A、实验①试管最终会充满水 |
| B、实验②试管中溶液变为血红色 |
| C、可用实验③装置除去CO2气体中含有的少量HCl杂质 |
| D、实验④CuSO4溶液中会形成一条光亮的通路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com