
【题目】已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:

回答下列问题:
(1)写出碳酸的主要的电离方程式 。若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+) 原来的十分之一(填“大于”、“小于”或“等于”).
(2))物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为 (用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
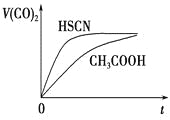
(3)25℃时,将 20mL0.1mol·L-1CH COOH 溶液和 20mL0.1mol·L-1HSCN 溶液分别与 20mL0.1mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图。反应初始阶段两种溶液产生 CO2 气体的速率存在明显差异的原因是 反应结束后,假设 NaHCO3 完全反应且气体全部逸出,则所得两溶液中,c(CH3COO-) _c(SCN-)(填“>”、“<”或“=”;)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)―c(CH3COO-)=_ mol/L(填代入数据后的计算式,不必算出具体数值)。
(5)向 NaClO 溶液中通入少量的 CO2,发生反应的离子方程式为 __________
【答案】(1)H2CO3 ![]() HCO3-+H+;大于;(2)e<a<d<c<b;(3)同浓度的HSCN比CH3CHOOH酸性强,与NaHCO3溶液反应快,<;(4)10-6-10-8;(5)CO2+H2O+ClO-=HCO3-+HClO。
HCO3-+H+;大于;(2)e<a<d<c<b;(3)同浓度的HSCN比CH3CHOOH酸性强,与NaHCO3溶液反应快,<;(4)10-6-10-8;(5)CO2+H2O+ClO-=HCO3-+HClO。
【解析】
试题分析:(1)碳酸是二元弱酸,要分步电离,第一步电离为主,因此主要电离方程式为:H2CO3 ![]() HCO3-+H+;加水稀释促进电离,因此稀释后c(H+)>原来的十分之一;(2)根据电离平衡常数,电离出H+能力:HSCN>CH3COOH>H2CO3>HClO>HCO3-,根据盐类水解规律,越弱越水解,因此pH由小到大的顺序是:e<a<d<c<b;(3) 同浓度的HSCN比CH3CHOOH酸性强,,与NaHCO3溶液反应快;两者恰好完全反应,生成溶质为CH3COONa、NaSCN,醋酸的酸性弱于HSCN,CH3COO-的水解程度大于SCN-的水解程度,即C(CH3COO-)<c(SCN-);(4)根据电荷守恒,c(Na+)+c(H+)=C(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6-10-8;(5)根据(2)的分析,离子反应方程式为:CO2+H2O+ClO-=HCO3-+HClO。
HCO3-+H+;加水稀释促进电离,因此稀释后c(H+)>原来的十分之一;(2)根据电离平衡常数,电离出H+能力:HSCN>CH3COOH>H2CO3>HClO>HCO3-,根据盐类水解规律,越弱越水解,因此pH由小到大的顺序是:e<a<d<c<b;(3) 同浓度的HSCN比CH3CHOOH酸性强,,与NaHCO3溶液反应快;两者恰好完全反应,生成溶质为CH3COONa、NaSCN,醋酸的酸性弱于HSCN,CH3COO-的水解程度大于SCN-的水解程度,即C(CH3COO-)<c(SCN-);(4)根据电荷守恒,c(Na+)+c(H+)=C(CH3COO-)+c(OH-),c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=10-6-10-8;(5)根据(2)的分析,离子反应方程式为:CO2+H2O+ClO-=HCO3-+HClO。


科目:高中化学 来源: 题型:
【题目】氢化钠(NaH)是一种离子化合物,遇水后放出氢气并生成一种碱,主要应用在有机合成和储氢材料方面。根据信息完成下列各空:
(1)氢化钠的电子式为____________。
(2)氢化钠与水反应的化学方程式为____________,反应的氧化剂为____________。该反应过程中,被破坏的化学键有____________(填数字序号,下同),形成的化学键有_______。
①离子键 ②极性共价键 ③非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 使酚酞变红色的溶液中:Na+、A13+、SO42-、Cl-
B. ![]() =10的溶液中:NH4+、Ca2+、 Cl-、NO3-
=10的溶液中:NH4+、Ca2+、 Cl-、NO3-
C. 在氯水中:Fe2+、K+、NO3-、SO42-
D. 水电离出的c(H+)=1×10-13molL-1的溶液中:K+、Na+、AlO2-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。如图表示反应中能量的变化;如图表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
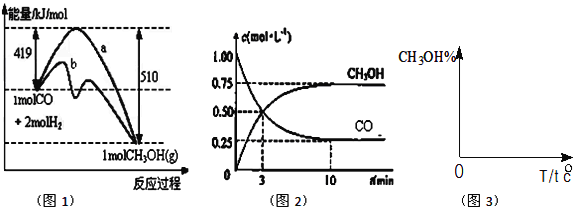
(1)在图1中,曲线_______(填:a或b)表示使用了催化剂;该反应属于_______(填:吸热、放热)反应。
(2)下列说法正确的是______________A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时 n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=________;在该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为_______________。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____(填“增大”、“减小”或“不变”)。
(4)请在图3中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线_______________(在曲线上标出P1、P2,且P1<P2)。
(5)有一类甲醇质子交换膜燃料电池,工作时将甲醇转化为甲酸,该电池的负极反应式为_______________。
(6)已知CO、H2的燃烧热为283kJ/mol、285.8kJ/mol,写出CH3OH(g)燃烧热的热化学方程式__________________。
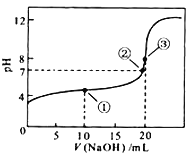
(7)常温下,用0.1000 molL-1NaOH溶液滴定20.00mL0.1000 molL-1CH3COOH溶液所得滴定曲线如图,则点①所示溶液中,关于CH3COOH、CH3COO-、H+、OH-4种微粒的等式为:____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置进行浓硫酸和木炭反应的实验,并检验有CO2和SO2两种气体生成。

回答下列问题:
(1)仪器a的名称为_________,A装置中反生反应的化学方程式为___________________________________________。
(2)虚线框内有一处错误,请指出______________________,
装置B的作用是___________________________________________。
(3)装置C中酸性KMnO4溶液用于除去SO2,其目的是________。(填序号)
甲:防止SO2干扰CO2的检验 乙:吸收CO2气体 丙:检验SO2
(4)装置E的现象是_______________________________,E中发生反应的离子方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①钾比水轻;②钾的熔点低;③钾与水反应时要放出热量;④钾与水反应后溶液呈碱性。某学生将一块金属钾投入滴有酚酞试液的水中,该实验能证明四点性质中的( )
A. ①④ B. ①②④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,可行的是( )
A.按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物
B.将白醋滴在润湿的pH试纸上,测定其pH
C.用氢氧化钠溶液除去CO2中的HCl气体
D.用BaCl2溶液除去KNO3溶液中少量的K2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com